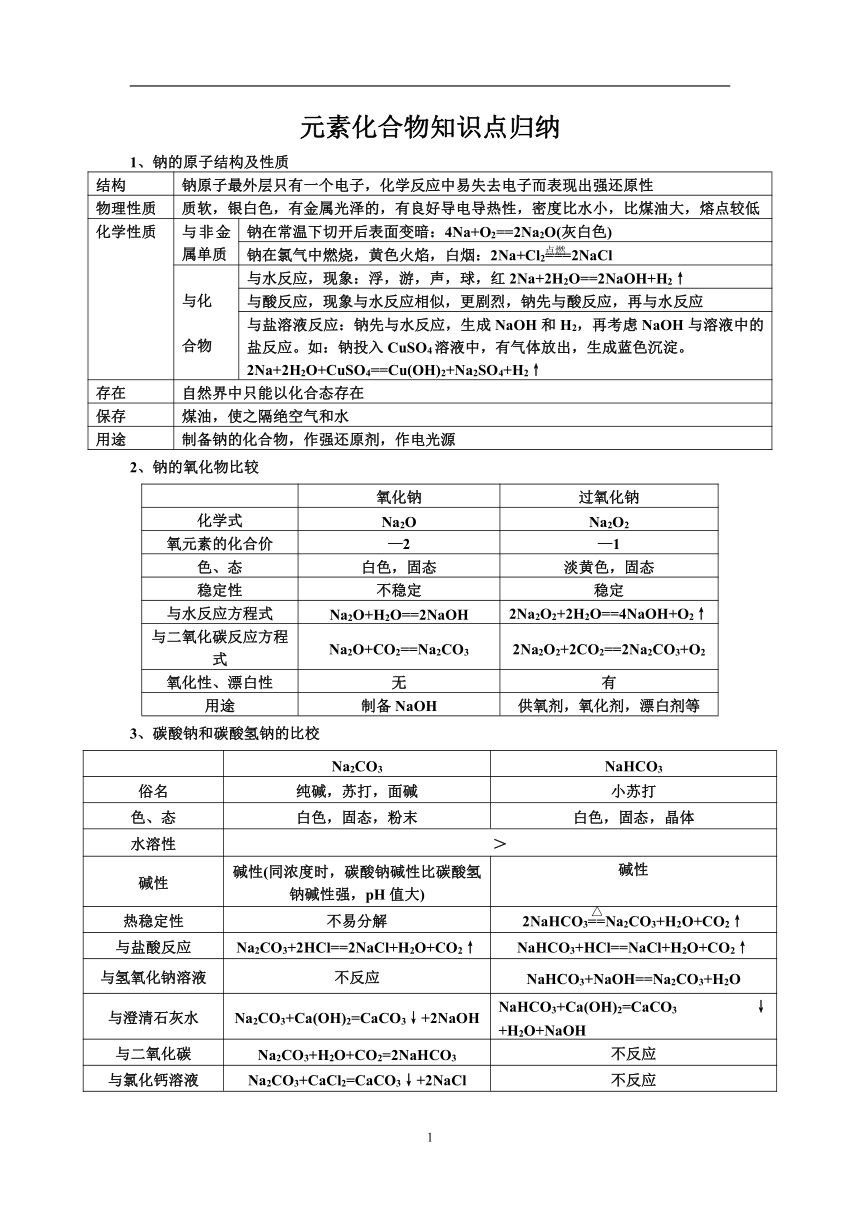
元素化合物知识点归纳 1、钠的原子结构及性质 结构 钠原子最外层只有一个电子,化学反应中易失去电子而表现出强还原性 物理性质 质软,银白色,有金属光泽的,有良好导电导热性,密度比水小,比煤油大,熔点较低 化学性质 与非金属单质 钠在常温下切开后表面变暗:4Na+O2==2Na2O(灰白色) 钠在氯气中燃烧,黄色火焰,白烟:2Na+Cl2===2NaCl 与化合物 与水反应,现象:浮,游,声,球,红2Na+2H2O==2NaOH+H2↑ 与酸反应,现象与水反应相似,更剧烈,钠先与酸反应,再与水反应 与盐溶液反应:钠先与水反应,生成NaOH和H2,再考虑NaOH与溶液中的盐反应。如:钠投入CuSO4溶液中,有气体放出,生成蓝色沉淀。2Na+2H2O+CuSO4==Cu(OH)2+Na2SO4+H2↑ 存在 自然界中只能以化合态存在 保存 煤油,使之隔绝空气和水 用途 制备钠的化合物,作强还原剂,作电光源 2、钠的氧化物比较 氧化钠 过氧化钠 化学式 Na2O Na2O2 氧元素的化合价 —2 —1 色、态 白色,固态 淡黄色,固态 稳定性 不稳定 稳定 与水反应方程式 Na2O+H2O==2NaOH 2Na2O2+2H2O==4NaOH+O2↑ 与二氧化碳反应方程式 Na2O+CO2==Na2CO3 2Na2O2+2CO2==2Na2CO3+O2 氧化性、漂白性 无 有 用途 制备NaOH 供氧剂,氧化剂,漂白剂等 3、碳酸钠和碳酸氢钠的比校 Na2CO3 NaHCO3 俗名 纯碱,苏打,面碱 小苏打 色、态 白色,固态,粉末 白色,固态,晶体 水溶性 > 碱性 碱性(同浓度时,碳酸钠碱性比碳酸氢钠碱性强,pH值大) 碱性 热稳定性 不易分解 2NaHCO3==Na2CO3+H2O+CO2↑ 与盐酸反应 Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaHCO3+HCl==NaCl+H2O+CO2↑ 与氢氧化钠溶液 不反应 NaHCO3+NaOH==Na2CO3+H2O 与澄清石灰水 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH 与二氧化碳 Na2CO3+H2O+CO2=2NaHCO3 不反应 与氯化钙溶液 Na2CO3+CaCl2=CaCO3↓+2NaCl 不反应 用途 重要化工原料,可制玻璃,造纸等 治疗胃酸过多,制作发酵粉等 4、铝及其化合物 Ⅰ、铝 ①物理性质:银白色,较软的固体,导电、导热,延展性 ②化学性质:Al—3e-==Al3+ a、与非金属:4Al+3O2==2Al2O3,2Al+3S==Al2S3,2Al+3Cl2==2AlCl3 b、与酸:2Al+6HCl==2AlCl3+3H2↑,2Al+3H2SO4==Al2(SO4)3+3H2↑ 常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸 c、与强碱:2Al+2NaOH+2H2O==2NaAlO2(偏铝酸钠)+3H2↑ (2Al+2OH-+2H2O==2AlO2-+3H2↑) 大多数金属不与碱反应,但铝却可以 d、铝热反应:2Al+Fe2O3===2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物 Ⅱ、铝的化合物 ①Al2O3(典型的两性氧化物) a、与酸:Al2O3+6H+==2Al3++3H2O b、与碱:Al2O3+2OH-==2AlO2-+H2O ②Al(OH)3(典型的两性氢氧化物):白色不溶于水的胶状物质,具有吸附作用 a、实验室制备:AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl, Al3++3NH3·H2O==Al(OH)3↓+3NH4+ b、与酸、碱反应:与酸 Al(OH)3+3H+==Al3++3H2O 与碱 Al(OH)3+OH-==AlO2-+2H2O ③KAl(SO4)2(硫酸铝钾) KAl(SO4)2·12H2O,十二水和硫酸铝钾,俗名:明矾 KAl(SO4)2==K++Al3++2SO42-,Al3+会水解:Al3++3H2O Al(OH)3+3H+ 因为Al(OH)3具有很强的吸附型,所以明矾可以做净水剂 5、铁 ①物理性质:银白色光泽,密度大,熔沸点高,延展性,导电导热性较好,能被磁铁吸引。铁在地壳中的含量仅次于氧、硅、铝,排第四。 ②化学性质: a、与非金属:Fe+S==FeS,3Fe+2O2===Fe3O4,2Fe+3Cl2===2FeCl3 b、与水:3Fe+4H2O(g)===Fe3O4+4H2 c、与酸(非氧化性酸):Fe+2H+==Fe2++H2↑ 与氧化性酸,如硝酸、浓硫酸,会被氧化成三价铁 d、与盐:如CuCl2、CuSO4等,Fe+Cu2+==Fe2++Cu Fe2+和Fe3+离子的检验: ①溶液是浅绿色的 Fe2+ ②与KSCN溶液作用不显红色,再滴 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

