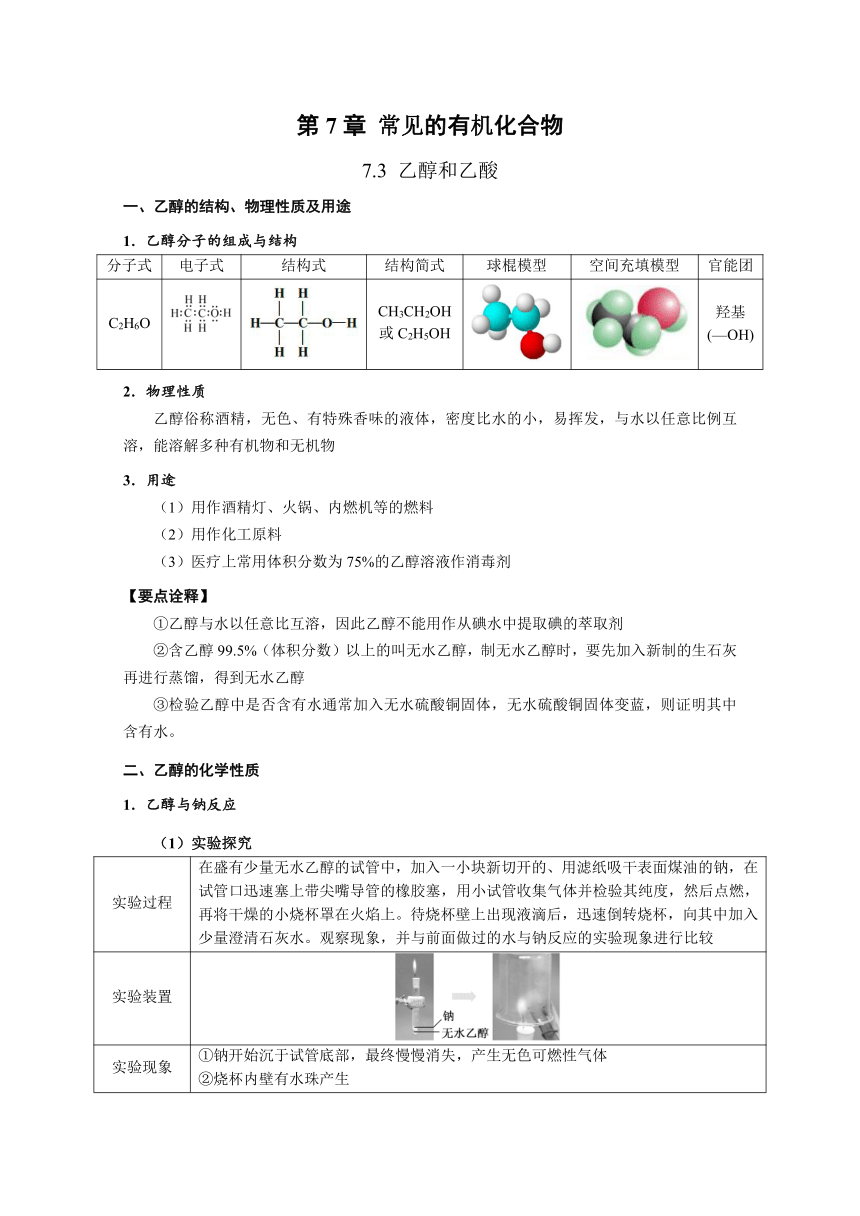
第7章 常见的有机化合物 7.3 乙醇和乙酸 一、乙醇的结构、物理性质及用途 1.乙醇分子的组成与结构 分子式 电子式 结构式 结构简式 球棍模型 空间充填模型 官能团 C2H6O CH3CH2OH 或C2H5OH 羟基(—OH) 2.物理性质 乙醇俗称酒精,无色、有特殊香味的液体,密度比水的小,易挥发,与水以任意比例互溶,能溶解多种有机物和无机物 3.用途 (1)用作酒精灯、火锅、内燃机等的燃料 (2)用作化工原料 (3)医疗上常用体积分数为75%的乙醇溶液作消毒剂 【要点诠释】 ①乙醇与水以任意比互溶,因此乙醇不能用作从碘水中提取碘的萃取剂 ②含乙醇99.5%(体积分数)以上的叫无水乙醇,制无水乙醇时,要先加入新制的生石灰再进行蒸馏,得到无水乙醇 ③检验乙醇中是否含有水通常加入无水硫酸铜固体,无水硫酸铜固体变蓝,则证明其中含有水。 二、乙醇的化学性质 1.乙醇与钠反应 (1)实验探究 实验过程 在盛有少量无水乙醇的试管中,加入一小块新切开的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃,再将干燥的小烧杯罩在火焰上。待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水。观察现象,并与前面做过的水与钠反应的实验现象进行比较 实验装置 实验现象 ①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体 ②烧杯内壁有水珠产生 ③向烧杯中加入澄清石灰水不变浑浊 实验结论 乙醇与钠反应产生了氢气 (2)反应的方程式:2C2H5OH+2Na → 2CH3CH2ONa+H2↑ (3)钠与乙醇、水反应的对比 水与钠反应 乙醇与钠反应 实验 现象 钠的变化 钠粒浮于水面,熔成闪亮的小球,并快速地四处游动,很快消失 钠粒开始沉于试管底部,未熔化,最终慢慢消失 声的现象 有“嘶嘶”的声响 无声响 气体检验 点燃,发出淡蓝色的火焰 点燃,发出淡蓝色的火焰 剧烈程度 钠与水剧烈反应 钠与乙醇缓慢反应 实验结论 密度大小 ρ(Na)<ρ(H2O) ρ(Na)>ρ(C2H5OH) 反应方程式 2Na+2H2O===2NaOH+H2↑ 2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ 反应实质 氢原子被置换 羟基氢原子被置换 羟基氢活泼性 水中氢原子>乙醇羟基氢原子 【要点诠释】 ①Na与乙醇的反应比与水的反应缓和的多,说明乙醇中羟基上的H原子没有水分子中羟基上的H原子活泼 ②钠与乙酸、水、乙醇反应的剧烈程度依次减弱 ③醇与Na反应时:2R—OH~2Na~H2,即:1 mol —OH生成0.5 mol H2 ④其他活泼金属也能与CH3CH2OH反应,如:2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑ 2.乙醇的氧化反应 (1)乙醇的燃烧反应:CH3CH2OH+3O22CO2+3H2O ①现象:产生淡蓝色火焰,放出大量的热 ②乙醇能作为绿色能源的原因:燃烧放出大量的热、燃烧产物无污染、可再生能源 (2)乙醇与氧气的催化氧化 ①实验探究 实验步骤 向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味 实验装置 实验现象 ①灼烧至红热的铜丝表面变黑,趁热将铜丝插入乙醇中,铜丝立即又变成红色 ②能闻到一股不同于乙醇的强烈的刺激性气味 实验结论 乙醇在加热和有催化剂(如Cu或Ag)存在的条件下,可被空气中的氧气氧化为乙醛 ②反应的方程式:2CH3CH2OH+O22CH3CHO+2H2O ③催化氧化的机理:乙醇催化氧化时,乙醇分子断开O—H键和与羟基直接相连的碳上的C—H键,形成一个C=O双键,脱下来的氢原子与氧气分子中的氧原子结合生成水。乙醇催化氧化生成乙醛时,乙醇分子并未得到氧,而是失去两个氢原子生成乙醛分子,因此乙醇变成乙醛的反应实质是去氢的反应,属于有机反应类型的氧化反应。(氧化反应:加氧去氢) ④乙醇催化氧化的过程 将弯成螺旋状的铜丝灼烧,铜丝表面变黑色 2Cu+O ... ...
~~ 您好,已阅读到文档的结尾了 ~~

