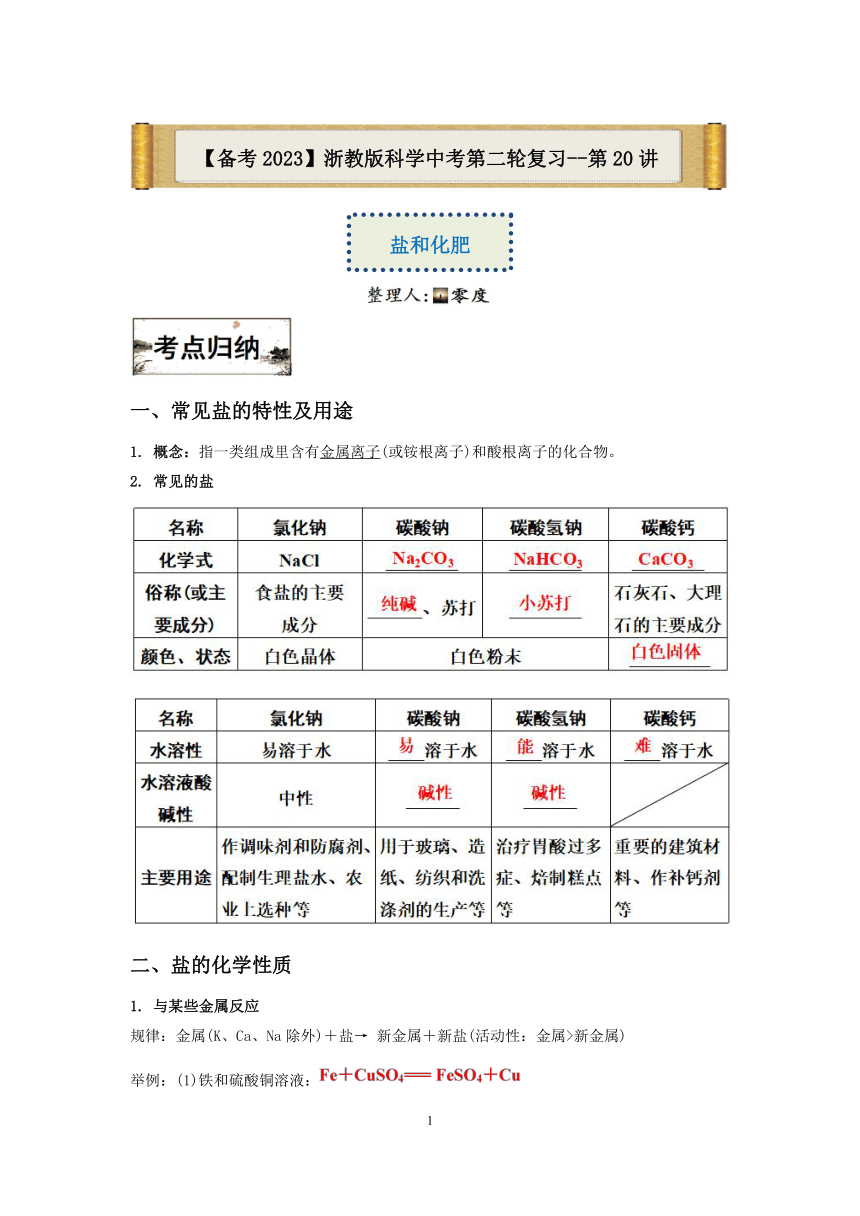
一、常见盐的特性及用途 1. 概念:指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。 2. 常见的盐 二、盐的化学性质 1. 与某些金属反应 规律:金属(K、Ca、Na除外)+盐→ 新金属+新盐(活动性:金属>新金属) 举例:(1)铁和硫酸铜溶液: (2)铜和硝酸银溶液: 2. 与酸反应 规律:盐+酸→ 新盐+新酸 举例:(1)稀盐酸和碳酸钙: (2)稀硫酸和氯化钡: 3. 与碱反应 规律:碱+盐→ 新碱+新盐 举例:(1)碳酸钠和氢氧化钡:Na2CO3+Ba(OH)2=== BaCO3↓+2NaOH (2)硫酸铜和氢氧化钠:CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4 4. 与某些盐反应 规律:盐+盐→ 新盐+新盐 举例:(1)硝酸银和氯化钠: (2)硫酸铜和氯化钡: 三、复分解反应及其应用 1. 概念:由两种化合物相互交换成分,生成另外两种化合物的反应。 2. 特点:双交换,价不变。 3. 表达式:AB+CD→ AD+CB 4. 常见的类型 【记忆口诀】常见盐的溶解性:钾钠铵硝皆可溶 盐酸盐中银不溶 硫酸盐中钡不溶 其他碳酸盐都不溶 5. 应用:判断物质间能否共存、进行物质的鉴别和除杂等。 四、化学肥料 五、氢氧化钠变质的探究 1. 变质的原因 氢氧化钠与空气中的CO2反应生成碳酸钠和水。反应的化学方程式为 2. 检验氢氧化钠是否变质→检验是否含有 (1)分析:能和CO32-反应产生明显现象,但不能和OH-反应或反应产生同样现象的离子有: (2)实验方案 3. 探究已变质的NaOH是部分变质还是全部变质 (1)变质后的成分 (2)分析:在有CO32-存在的情况下检验是否有OH-,应先除去CO32-,再检验OH-: 除去CO32- ———含Ca2+、Ba2+的物质(如CaCl2、BaCl2等)(不能引入OH-)。 (3)实验方案 4. 实验反思 氢氧化钠应密封保存。 六、粗盐提纯 一、粗盐中难溶性杂质的去除 1. 实验用品 托盘天平(含砝码)、纸片、漏斗、药匙、烧杯、量筒、胶头滴管、玻璃棒、铁架台(带铁圈)、滤纸、酒精灯、蒸发皿、坩埚钳、石棉网、火柴。 2. 实验操作步骤图 3. 实验步骤 (1)称取:称量一定量的粗盐。 (2)溶解:将粗盐逐渐加入水中并用玻璃棒不断搅拌,直到粗盐不再溶解为止。(称量剩余粗盐的质量,计算溶解的粗盐的质量) (3)过滤:将粗盐水用玻璃棒引流入漏斗中过滤,若滤液浑浊,则应重新过滤。 (4)蒸发:将过滤后的澄清滤液倒入蒸发皿中,边加热边用玻璃棒不断搅拌,当蒸发皿中出现较多固体时停止加热,利用余热将其蒸干。 (5)计算产率:用玻璃棒把蒸发皿中的晶体转移到纸上称量,得到精盐质量,计算产率: 二、粗盐中可溶性杂质的去除 1. 粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故除杂实质为除去Ca2+、Mg2+、SO42-(填离子符号)。 2. 方法 (1)选除杂试剂 (2) 除杂流程 ①加入过量的BaCl2溶液———除去Na2SO4; ②加入过量的NaOH溶液———除去MgCl2; ③加入过量的Na2CO3溶液———除去CaCl2、BaCl2; ④加入稀盐酸———除去NaOH、Na2CO3。 例1、Na2CO3 的水溶液呈碱性,下列说法错误的是( ) A.碳酸钠在水中会电离出 OH- B.往碳酸钠溶液中加稀硫酸后溶液的 pH降低 C.碳酸钠溶液中存在 OH- D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色 例2、在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图像能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系是( ) 例3、硫酸铜、硝酸铜具有一相似的化学质。请回答: (1)硫酸铜、硝酸铜两种物质的溶液均显_____色,因为它们部具有_____离子。 (2)向硫酸铜,硝酸铜两种物质的液中分别加入BaCl2溶液,能发生反应的物质是_____(填化学式),化学方程式是_____。 (3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根根离子转变成沉淀,该净物的化学式为_____。 例4、某校科学兴趣小组为测定某硝酸铵样品的 ... ...
~~ 您好,已阅读到文档的结尾了 ~~