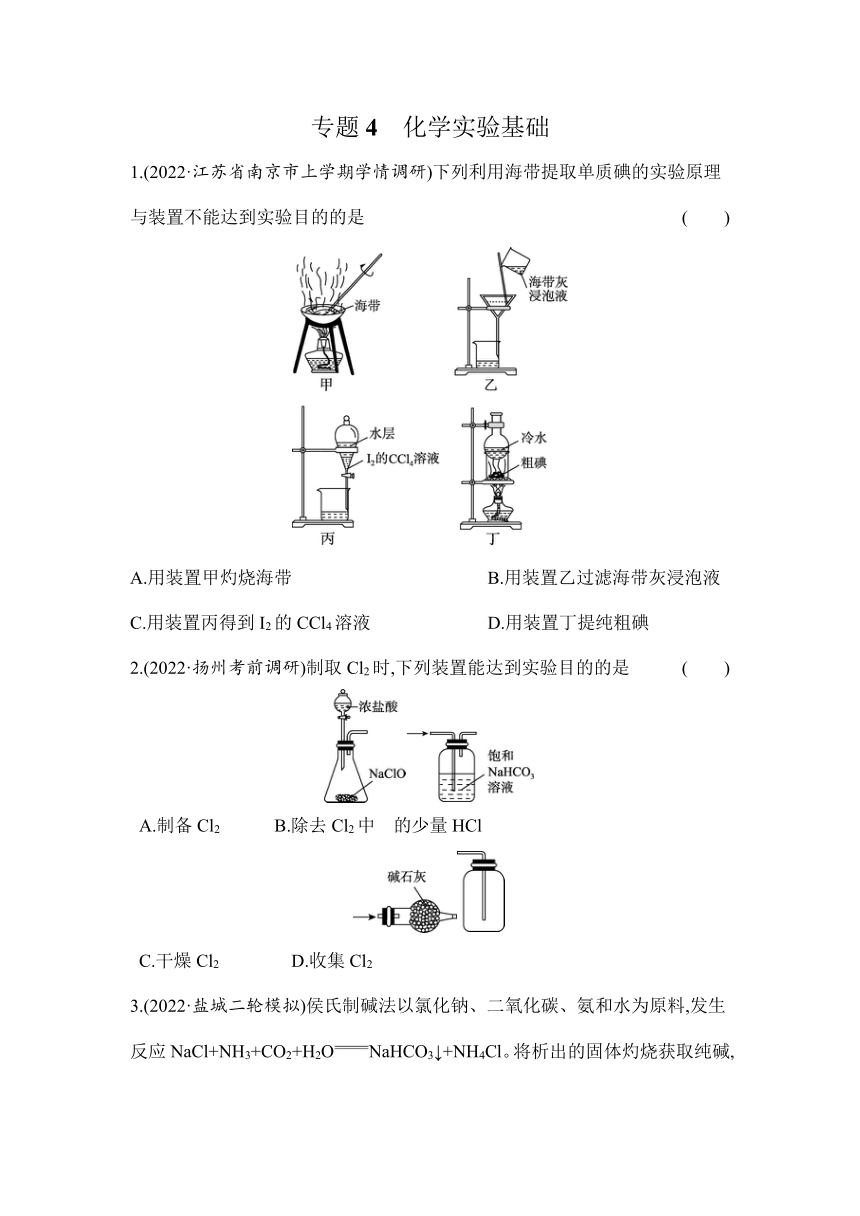
专题4 化学实验基础 1.(2022·江苏省南京市上学期学情调研)下列利用海带提取单质碘的实验原理与装置不能达到实验目的的是 ( ) A.用装置甲灼烧海带 B.用装置乙过滤海带灰浸泡液 C.用装置丙得到I2的CCl4溶液 D.用装置丁提纯粗碘 2.(2022·扬州考前调研)制取Cl2时,下列装置能达到实验目的的是 ( ) A.制备Cl2 B.除去Cl2中 的少量HCl C.干燥Cl2 D.收集Cl2 3.(2022·盐城二轮模拟)侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关模拟侯氏制碱法的实验原理和装置能达到实验目的的是 ( ) A 制取氨气 B 制 NaHCO3 C 分离 NaHCO3 D 制 Na2CO3 4.(2022·江苏省南京市、盐城市一模)由重晶石矿(主要成分是BaSO4,还含有SiO2等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。 下列说法正确的是 ( ) A.为提高原料的利用率,“高温焙烧”前原料需经研磨处理 B.“高温焙烧”和“结晶”两处操作均需用到蒸发皿 C.在“高温焙烧”焦炭和BaSO4的反应中,氧化剂与还原剂的物质的量之比为4∶1 D.因盐酸具有挥发性,上述流程中须用硫酸代替盐酸进行浸取 5.(2022·江苏省连云港市第二次调研)已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:3Mn+2H2O2Mn+MnO2↓+4OH-。下列用Cl2氧化K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是 ( ) A.用装置甲制取Cl2 B.用装置乙除去Cl2中的HCl C.用装置丙使K2MnO4转化成KMnO4 D.用装置丁分离出溶液中的MnO2 6.(2022·江苏省盐城市上学期期中考试)工业上一种从海水中制备碘的方法为:取净化除氯后的含碘海水,加入AgNO3溶液,富集得到AgI悬浊液,进而制得粗碘。从AgI悬浊液中回收I2的流程如图1所示。 下列有关说法正确的是 ( ) A.Fe粉与AgI悬浊液反应的离子方程式为Fe+2Ag+Ag+Fe2+ B.可在含碘海水中直接通入Cl2制备粗碘 C.如图2所示I2的晶胞中有14个I2分子 D.流程中沉淀可进一步转化,实现AgNO3的循环使用 7.(2022·江苏省连云港市第二次调研)一种I2的制备工艺流程如下: 下列说法不正确的是 ( ) A.“富集”得到的悬浊液中含有AgI,1个AgI晶胞(如图)中含有4个I- B.“转化”过程中的离子反应方程式为Fe+2AgI2Ag+Fe2++2I- C.“沉淀”与足量的浓硝酸反应,氧化产物可循环使用,还原产物为NO D.“氧化”过程中若氯气过量,单质碘的产率降低,可能原因是I2被进一步氧化 8.(2022·江苏省南京市、盐城市第一次模拟)室温下,通过下列实验探究NH4Fe(SO4)2溶液的性质(假设实验前后溶液体积不变)。 实验 实验操作和现象 1 用pH试纸测定0.1 mol·L-1 NH4Fe(SO4)2溶液的pH,测得pH约为5 2 向0.1 mol·L-1 NH4Fe(SO4)2溶液中加入Ba(OH)2溶液,产生沉淀 3 向0.1 mol·L-1 NH4Fe(SO4)2溶液中通入足量的NH3,产生红褐色沉淀 4 向0.1 mol·L-1 NH4Fe(SO4)2溶液中加入NaHS溶液,产生浅黄色沉淀 下列说法正确的是 ( ) A.0.1 mol·L-1 NH4Fe(SO4)2溶液中存在:c(N )+3c(Fe3+)=) B.实验2中沉淀成分仅为Fe(OH)3 C.实验3得到的溶液中有c(N )+c(NH3·H2O)+c(S)>0.3 mol·L-1 D.实验4中发生反应的离子方程式为2Fe3++2HS-2Fe2++2S↓+H2↑ 9.(2022·江苏省苏北四市上学期期末调研)制取少量SO2并得到CuSO4·5H2O晶体的实验,能达到目的的是 ( ) A 制SO2 B 收集 SO2 C 分离Cu与 CuSO4 溶液 D 蒸干溶液 得CuSO4· 5H2O晶体 专题4 化学实验基础 1.A 解析:A项,蒸发皿用来加热蒸发液体,灼烧固体海带应在坩埚中进行,符合题意;B项,过滤是分离不溶性固体与液体,乙装置可分离出含碘离子的溶液,不符合题意;C项,I2的CCl4溶液在下层,水在上层,可通过分液漏斗分离,不符合题意;D ... ...
~~ 您好,已阅读到文档的结尾了 ~~

