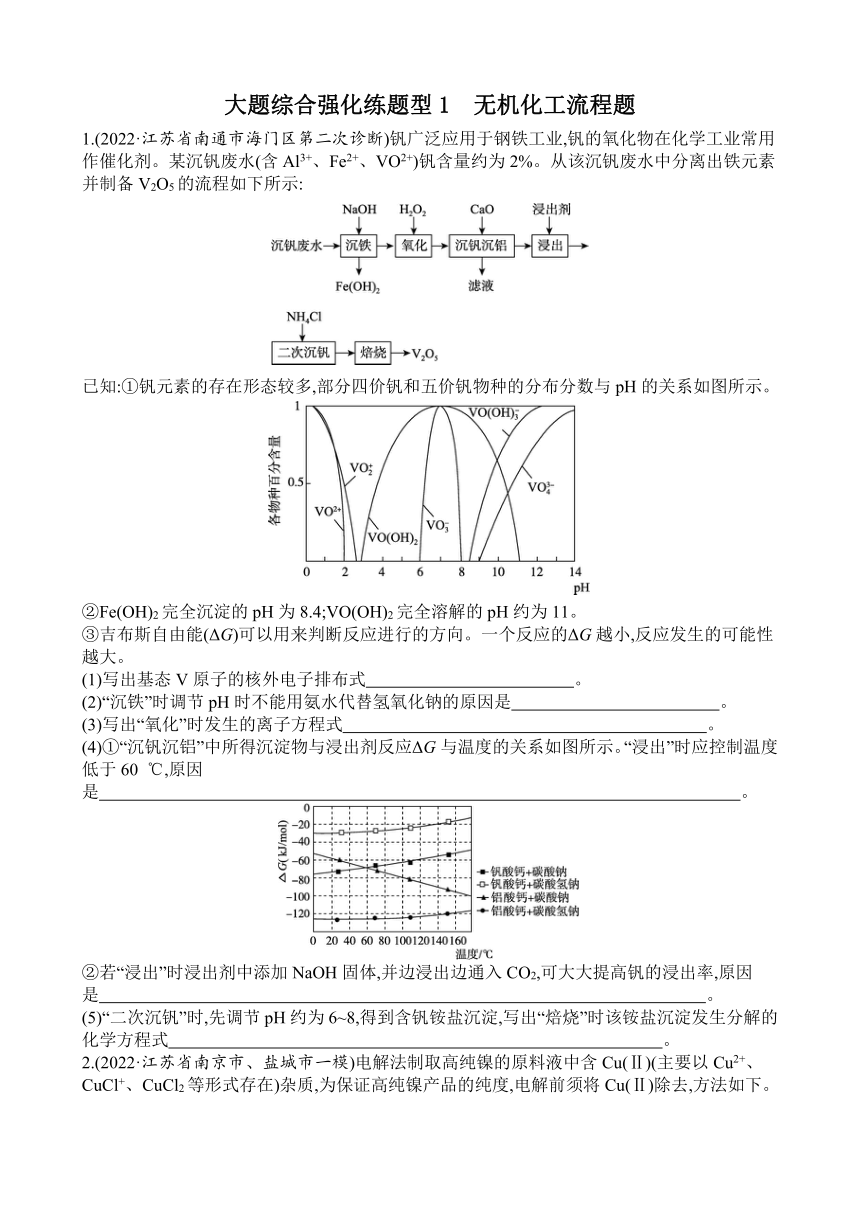
大题综合强化练题型1 无机化工流程题 1.(2022·江苏省南通市海门区第二次诊断)钒广泛应用于钢铁工业,钒的氧化物在化学工业常用作催化剂。某沉钒废水(含Al3+、Fe2+、VO2+)钒含量约为2%。从该沉钒废水中分离出铁元素并制备V2O5的流程如下所示: 已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。 ②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。 ③吉布斯自由能(ΔG)可以用来判断反应进行的方向。一个反应的ΔG越小,反应发生的可能性越大。 (1)写出基态V原子的核外电子排布式 。 (2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是 。 (3)写出“氧化”时发生的离子方程式 。 (4)①“沉钒沉铝”中所得沉淀物与浸出剂反应ΔG与温度的关系如图所示。“浸出”时应控制温度低于60 ℃,原因是 。 ②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是 。 (5)“二次沉钒”时,先调节pH约为6~8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式 。 2.(2022·江苏省南京市、盐城市一模)电解法制取高纯镍的原料液中含Cu(Ⅱ)(主要以Cu2+、CuCl+、CuCl2等形式存在)杂质,为保证高纯镍产品的纯度,电解前须将Cu(Ⅱ)除去,方法如下。 (1)S-SO2除铜:向原料液中加入适量细硫粉并鼓入SO2,将Cu(Ⅱ)转化为CuS沉淀除去。Cu2+沉淀时发生反应的离子方程式为 。 (2)NiS除铜:向原料液中加入活性NiS粉末,将Cu(Ⅱ)转化为CuS沉淀除去。过滤后的滤渣即为除铜渣(含NiS、CuS等)。 ①室温下,CuCl+和活性NiS粉末反应的离子方程式为 ;该反应的平衡常数表达式为K= 。 ②如图1所示,将活性NiS粉末陈化(露置)超过7小时后再用于除铜的效果明显变差,其原因可能是 。 ③除铜渣中铜镍质量比随原料液pH的变化如图2所示,实验测得溶液pH=3.5时除铜渣中铜镍质量比最大,其原因可能是 。 3.(2022·江苏省盐城市上学期期中考试)工业上常利用软锰矿浆(主要成分MnO2,杂质为SiO2、Fe、Al2O3等)制备高纯硫酸锰产品。 (1)在稀硫酸介质中还原。 ①投入处理后的废铁屑还原MnO2,生成Fe3+发生反应的离子方程式为 。 ②湿法还原软锰矿浆制备硫酸锰的最佳工艺条件如图1、图2所示。 (ⅰ)由图1可知反应控制的最佳温度约为50 ℃,其原因是 。 (ⅱ)由图2可知反应最佳投料比n(H2SO4)∶n(Fe)∶n(MnO2)=2.1∶0.78∶1,结合反应原理说明采用此比值的原因是 。 (2)制备高纯度MnSO4溶液。 已知:①Ksp(CaF2)=4.0×10-11,Ksp(MnF2)=5.0×10-3。 ②常温下溶液中金属离子开始沉淀和完全沉淀的pH如表所示。 物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2 开始沉淀时(c=0.01 mol·L-1)的pH 6.5 1.5 3.3 7.7 完全沉淀时(c=1.0×10-5mol·L-1)的pH 9.7 3.7 5.2 9.8 设计制备高纯度MnSO4溶液的实验方案:将还原后的混合溶液过滤, ,过滤, ,得到高纯度MnSO4溶液。(实验中须使用的试剂:5%H2O2溶液、CaCO3、MnF2) 4.(2022·江苏省启东市第一次质量监测)以软锰矿浆(主要成分MnO2)和烟气(含有SO2、O2等)为原料回收富集硫酸锰及制取MnCO3。 (1)向一定量软锰矿浆中匀速通入烟气,溶液中c(S)、c(Mn2+)、pH及随吸收时间的变化如图所示。 反应一段时间后,浸出液中S浓度高于Mn2+浓度,其主要原因是 。 ②溶液中c(S)的增加呈现由慢到快的趋势,其主要原因是 , 请设计实验方案证明 。 (2)由制得的MnSO4溶液制备高纯MnCO3的操作步骤: 。 [已知MnCO3难溶 ... ...
~~ 您好,已阅读到文档的结尾了 ~~