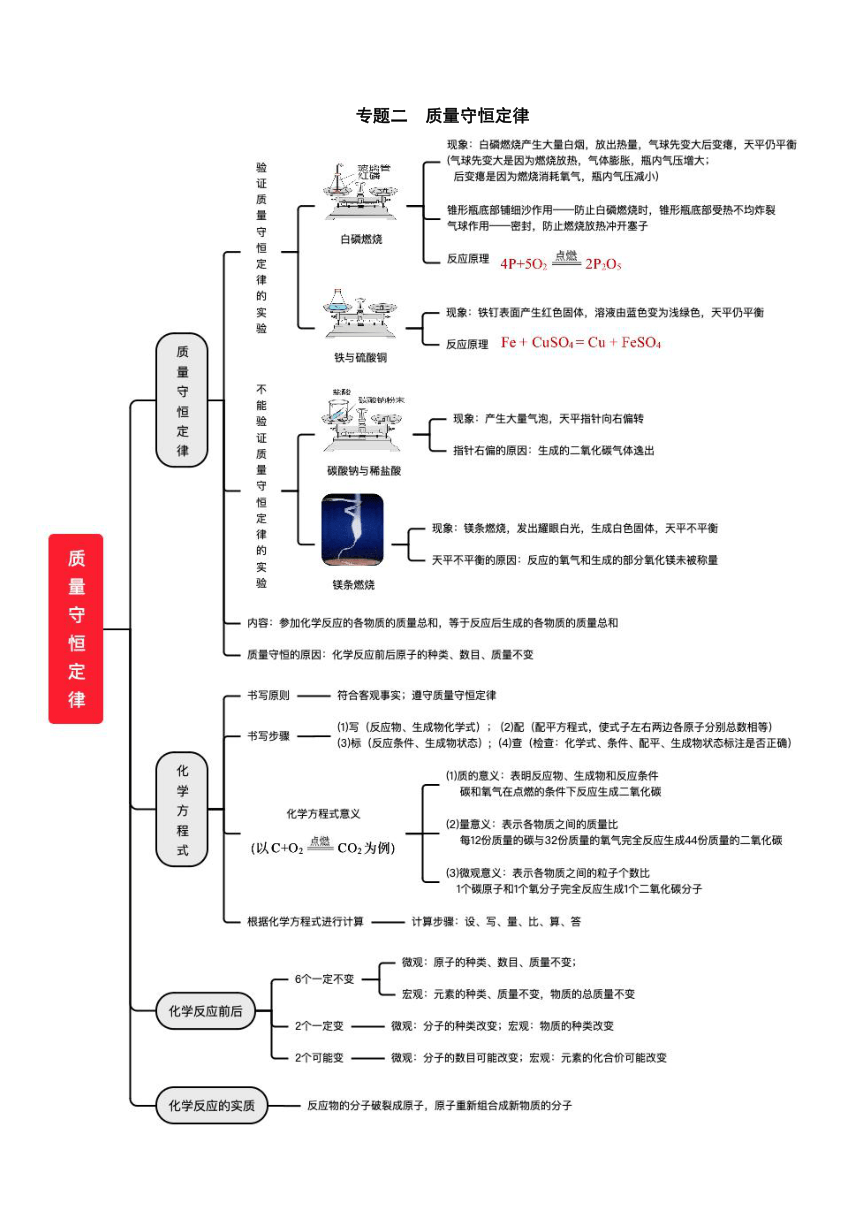
专题二 质量守恒定律 质量守恒定律的理解 1.质量守恒定律:参加化学反应的各物质质量总和,等于反应后生成的各物质的质量总和。(注意:适用所有化学变化) 2.微观解释质量守恒定律的原因: 电解水反应微观过程 化学反应前后物质的质量总和相等的本质原因是: 化学反应是分子破裂成原子,原子重新组合成新的分子。 化学反应前后,原子的种类、数目、质量都不变。 实验验证质量守恒定律 实验1 4P+5O22P2O5 实验装置 实验现象 红磷燃烧,产生大量白烟,放出大量的热,气球膨胀,待装置冷却后,气球变瘪。反应后的物质总质量m2与反应前的物质总质量m1相等。 实验分析 气球变化的原因? 气球先胀大是因为红磷燃烧放热,后缩小是因为消耗了锥形瓶内氧气,使瓶内气体压强小于外界大气压; 气球的作用是什么? 是形成密闭体系并缓冲气压。 实验2 Fe + CuSO4 = Cu + FeSO4 实验 装置 步骤1:铁钉放在锥形瓶外 称量纸上称量 步骤2:将铁钉小心放入硫酸铜溶液中,观察天平的平衡情况 实验现象 铁钉表面覆盖一层红色的物质,溶液由蓝色变为浅绿色, 反应前后,物质的总质量不变,天平保持平衡。 实验3:化学实验验证质量守恒定律的注意事项 实验方案 实验现象 白色粉末溶解,有大量气泡迅速产生。天平向右偏转。 产生白色固体(还有少量白烟产生), 天平不平衡,发出耀眼的白光,放出热量。 实验结论 所有的化学反应均遵守质量守恒定律。 有气体参加或气体生成(或者有烟、雾状物质生成的反应), 要验证质量守恒定律,必须在密闭容器里进行。 化学方程式的意义 化学方程的书写 书写步骤 写———左写反应物,右写生成物,中间连短线; 配———配平;使反应前后各原子总数相等; 等———短线改等号; 注———在等号的上方或下方注明反应条件 标———标出生成物中气体与沉淀(气体符号“↑”:沉淀符号“↓”) 查———检查化学式是否写错、是否配平、条件和生成物状态是否标注准确。 化学方程的配平方法 (1)最小公倍数法 步骤: ①找出两边各出现一次的元素,选择同种原子的个数最多的原子,求最小公倍数,得分子个数; ②使该原子数目在反应前后都为所求出的最小公倍数; ③一般先从氧原子入手,再配平其他原子。 (2)观察法 步骤: ①从化学式较复杂的一种生成物(反应物)推求有关反应物(生成物)化学式的化学计量数和这一生成物的化学计量数; ②根据求得的化学式的化学计量数,再找出其它化学式的相应计量数,这样即可配平。 (3)奇数配偶法 这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶。 步骤: ①找出在化学反应中出现次数最多的元素; ②从原子数为单数的元素入手(一般为氧元素),即乘2; ③由已推求出的化学计量数决定其它化学式的化学计量数。 (4)分数配平法 此方法能配平有单质参加反应或有单质生成的化学反应。 步骤: ①先配平化合物中各元素的原子; ②用分数配平单质元素的原子; ③去分母,使配平后的化学计量数为整数。 (5)定一法 找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数。若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法。 根据化学方程计算 计算依据:利用化学方程式能反映物质间的质量比,且质量比呈正比例关系。 ... ...
~~ 您好,已阅读到文档的结尾了 ~~