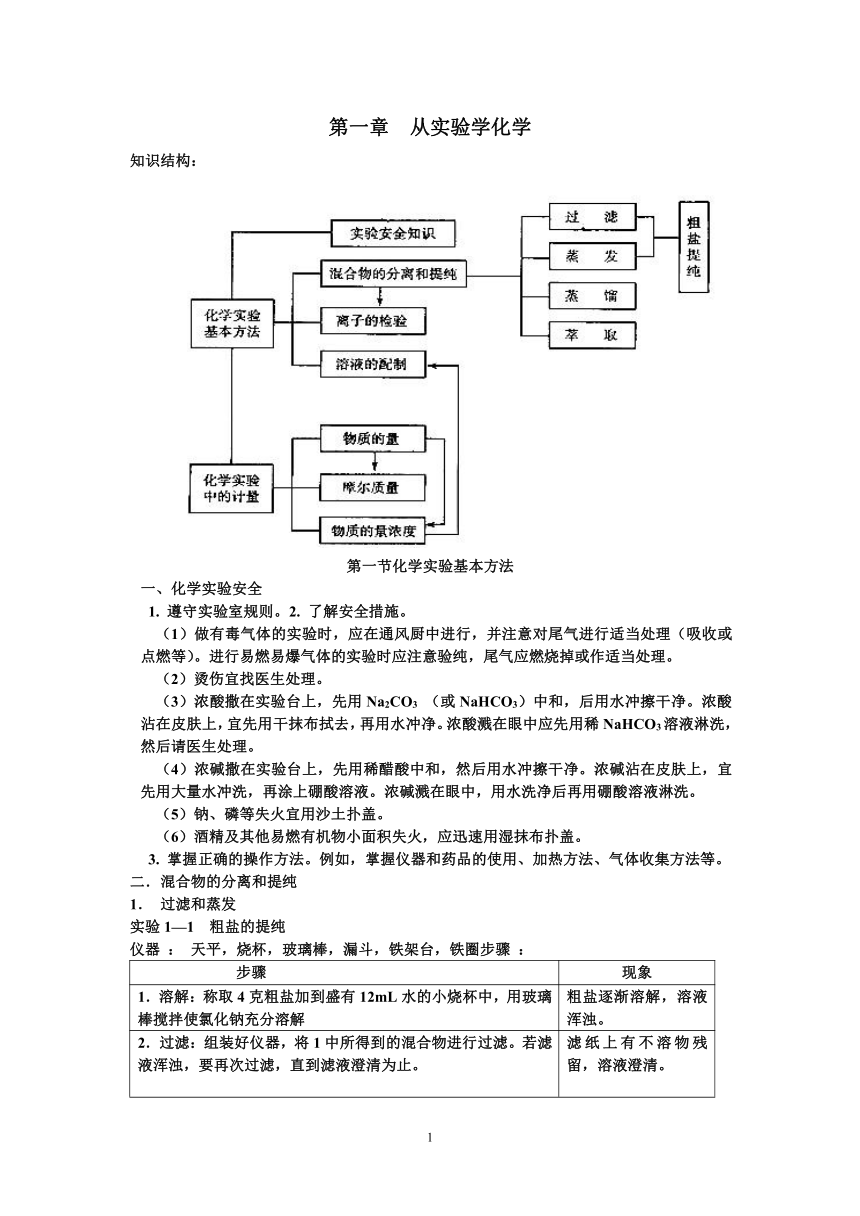
第一章 从实验学化学 知识结构: 第一节化学实验基本方法 一、化学实验安全 1. 遵守实验室规则。2. 了解安全措施。 (1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2)烫伤宜找医生处理。 (3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。 (4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。 (5)钠、磷等失火宜用沙土扑盖。 (6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。 3. 掌握正确的操作方法。例如,掌握仪器和药品的使用、加热方法、气体收集方法等。 二.混合物的分离和提纯 过滤和蒸发 实验1—1 粗盐的提纯 仪器 : 天平,烧杯,玻璃棒,漏斗,铁架台,铁圈步骤 : 步骤 现象 1.溶解:称取4克粗盐加到盛有12mL水的小烧杯中,用玻璃棒搅拌使氯化钠充分溶解 粗盐逐渐溶解,溶液浑浊。 2.过滤:组装好仪器,将1中所得到的混合物进行过滤。若滤液浑浊,要再次过滤,直到滤液澄清为止。 滤纸上有不溶物残留,溶液澄清。 3.蒸发:将过滤后的澄清溶液转入蒸发皿,加热,并用玻璃棒搅拌,防止液滴飞溅。当出现较多固体时停止加热,余热蒸干。 蒸发皿中产生了白色固体。 注意事项:(1)一贴,二低,三靠。 (2)蒸馏过程中用玻璃棒搅拌,防止液滴飞溅。 蒸馏和萃取(1) 蒸馏 原理:利用沸点的不同,处去难挥发或不挥发的杂质。 实验1--3 从自来水制取蒸馏水 仪器:温度计,蒸馏烧瓶,石棉网,铁架台,酒精灯,冷凝管,牛角管,锥形瓶。 操作:连接好装置,通入冷凝水,开始加热。弃去开始镏出的部分液体,用锥形瓶收集约10mL液体,停止加热. 现象: 随着加热,烧瓶中水温升高至100度后沸腾,锥形瓶中收集到蒸馏水. 注意事项:①温度计的水银球在蒸馏烧瓶的支管口处。 ②蒸馏烧瓶中放少量碎瓷片--防液体暴沸。 ③冷凝管中冷却水从下口进,上口出。 ④先打开冷凝水,再加热。 ⑤溶液不可蒸干。 (2)萃取 原理: 用一种溶把溶质从它与另一溶剂所组成的溶液里提取出来. 仪器: 分液漏斗, 烧杯 步骤: ①检验分液漏斗是否漏水. ②量取10mL碘的饱和溶液倒入分液漏斗, 注入4mLCCl4,盖好瓶塞. ③用右手压住分液漏斗口部, 左手握住活塞部分, 把分液漏斗倒转过来用力振荡. ④将分液漏斗放在铁架台上,静置. ⑤待液体分层后, 将分液漏斗上的玻璃塞打开,从下端口放出下层溶液,从上端口倒出上层溶液. 注意事项: A 检验分液漏斗是否漏水. B 萃取剂: 互不相溶,不能反应. C 上层溶液从上口倒出,下层溶液从下口放出. 离子检验 离子 所加试剂 现象 离子方程式 Cl- AgNO3,稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓ SO42- Ba(NO3)2稀HNO3 白色沉淀 SO42-+Ba2+=BaSO4↓ 四.除杂 1.原则:杂转纯、杂变沉、化为气、溶剂分。 2.注意:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。 第二节 化学计量在实验中的应用 一、物质的量的单位――摩尔 1.物质的量(n)是表示含有一定数目粒子的集体的物理量。七个基本物理量之一。 2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。 3.阿伏加德罗常数:1mol物质中所含的“微粒数”。 把6.02 X1023mol-1叫作阿伏加德罗常数。 4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA 5.摩尔质量(M) (1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g ... ...
~~ 您好,已阅读到文档的结尾了 ~~