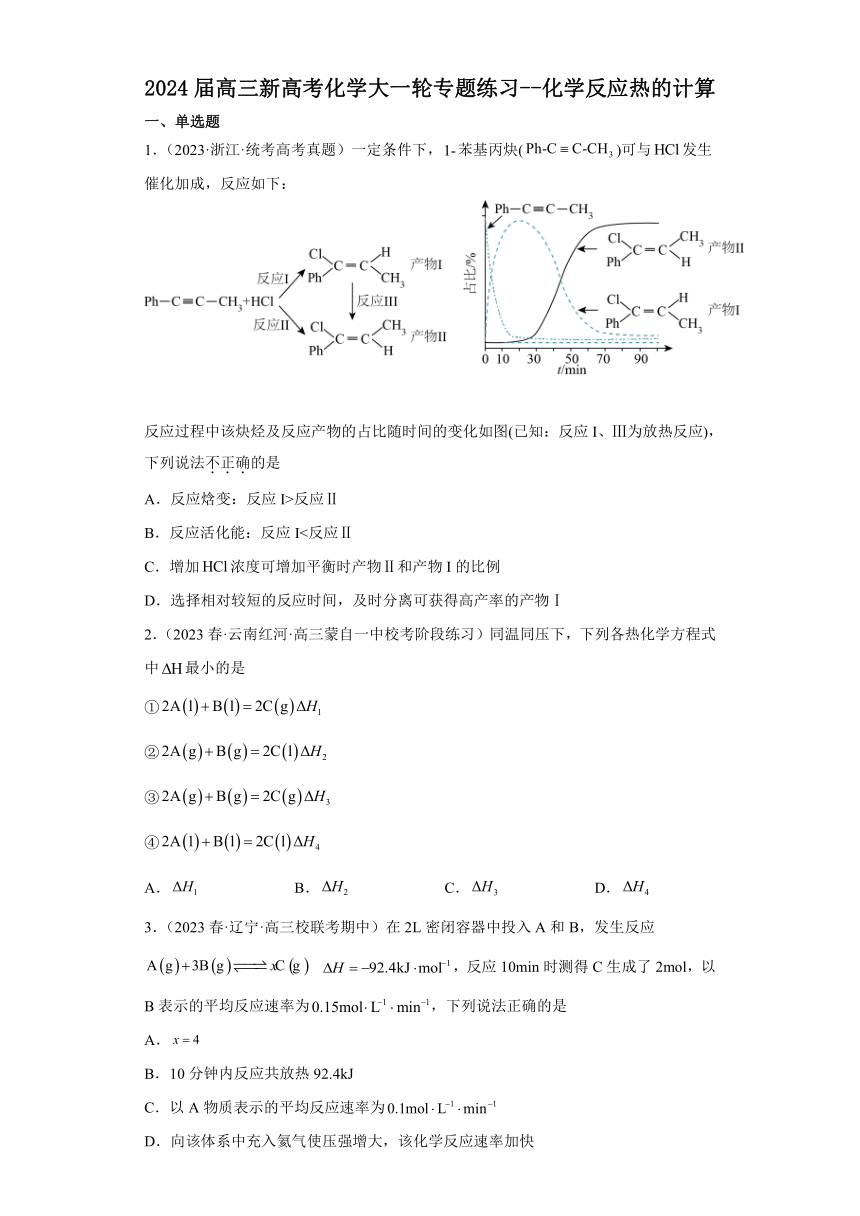
2024届高三新高考化学大一轮专题练习--化学反应热的计算 一、单选题 1.(2023·浙江·统考高考真题)一定条件下,苯基丙炔()可与发生催化加成,反应如下: 反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是 A.反应焓变:反应I>反应Ⅱ B.反应活化能:反应I<反应Ⅱ C.增加浓度可增加平衡时产物Ⅱ和产物I的比例 D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ 2.(2023春·云南红河·高三蒙自一中校考阶段练习)同温同压下,下列各热化学方程式中最小的是 ① ② ③ ④ A. B. C. D. 3.(2023春·辽宁·高三校联考期中)在2L密闭容器中投入A和B,发生反应 ,反应10min时测得C生成了2mol,以B表示的平均反应速率为,下列说法正确的是 A. B.10分钟内反应共放热92.4kJ C.以A物质表示的平均反应速率为 D.向该体系中充入氦气使压强增大,该化学反应速率加快 4.(2023春·浙江宁波·高三效实中学校考期中)下列说法正确的是 A.浓硫酸与NaOH溶液反应生成1mol水时放出57.3kJ热量 B.稀硫酸和稀Ba(OH)2反应生成1mol水时放出57.3kJ热量 C.1L 1mol/L稀硫酸被NaOH溶液恰好完全中和放出57.3kJ热量 D.0.1mol/L HCl和0.2mol/L NaOH溶液反应的中和热的焓变(ΔH)为-57.3kJ/mol 5.(2023春·浙江宁波·高三效实中学校考期中)在25 oC,101 kPa下,0.2 mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92 kJ热量。表示上述反应的热化学方程式正确的是 A.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(g) H=+259.92 kJ/mol B.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(l) H=-259.92 kJ/mol C.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(l) H=+2599.2 kJ/mol D.2C2H2(g)+5O2(g) = 4CO2(g)+2H2O(l) H=-2599.2 kJ/mol 6.(2023春·陕西宝鸡·高三统考期中)下列推论正确的是 A.S(g)+O2(g)=SO2(g) △H1,S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H =-57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ C.C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 D.CaCO3(s)=CaO(s)+CO2(g) △H >0,△S>0,则:该反应任何温度下都能自发进行 7.(2023春·广东·高三惠州一中校联考阶段练习)甲醇脱氢法制HCOOCH3工艺过程涉及如下反应: 反应Ⅰ:2CH3OH(g)HCOOCH3(g)+2H2(g) ΔH1=+135.4 kJ·mol-1 反应Ⅱ:CH3OH(g) CO(g)+2H2(g) ΔH2=+106.0 kJ·mol-1 向容积为10 L的恒容密闭容器中通入1 mol CH3OH(g)发生上述反应,反应相同时间,测得CH3OH的转化率和HCOOCH3的选择性随温度变化如图所示。(已知:HCOOCH3的选择性=) 下列说法错误的是 A.HCOOCH3(g) 2CO(g)+2H2(g) ΔH=+76.6 kJ·mol-1 B.实线代表的是CH3OH的转化率 C.553 K时,H2的体积分数为0.25 D.高于553 K时,虚线趋势下降可能是因为HCOOCH3分解 8.(2023春·广东深圳·高三校联考期中)某反应的反应物和生成物的相对能量如图所示,下列有关说法正确的是 A.该反应的发生不需要加热或点燃 B.该反应可看成是热能转化为化学能被生成物所“储存” C.该图可表示灼热的木炭与二氧化碳反应过程的能量变化 D.该反应过程反应物断键吸收的能量小于生成物成键释放的能量 9.(2022秋·陕西西安·高三长安一中校考期末)相同的温度和压强下,有关下列两个反应的说法不正确的是 反应 ΔH/kJ mol-1 Δn ΔS/J K mol-1 MgCO3(s)=MgO(s)+CO2(g) 117.6 1 a CaCO3(s)=CaO(s)+CO2(g) 177.9 1 b 注:其中Δn表示反应方程式中气体系数差; A.因为Δn相同,所以a与b大小相近 B.a-b=S[MgO(s)]+S[CaCO3(s)]-S[MgCO3(s)]-S[CaO(s)] C.热分解温度:M ... ...
~~ 您好,已阅读到文档的结尾了 ~~

