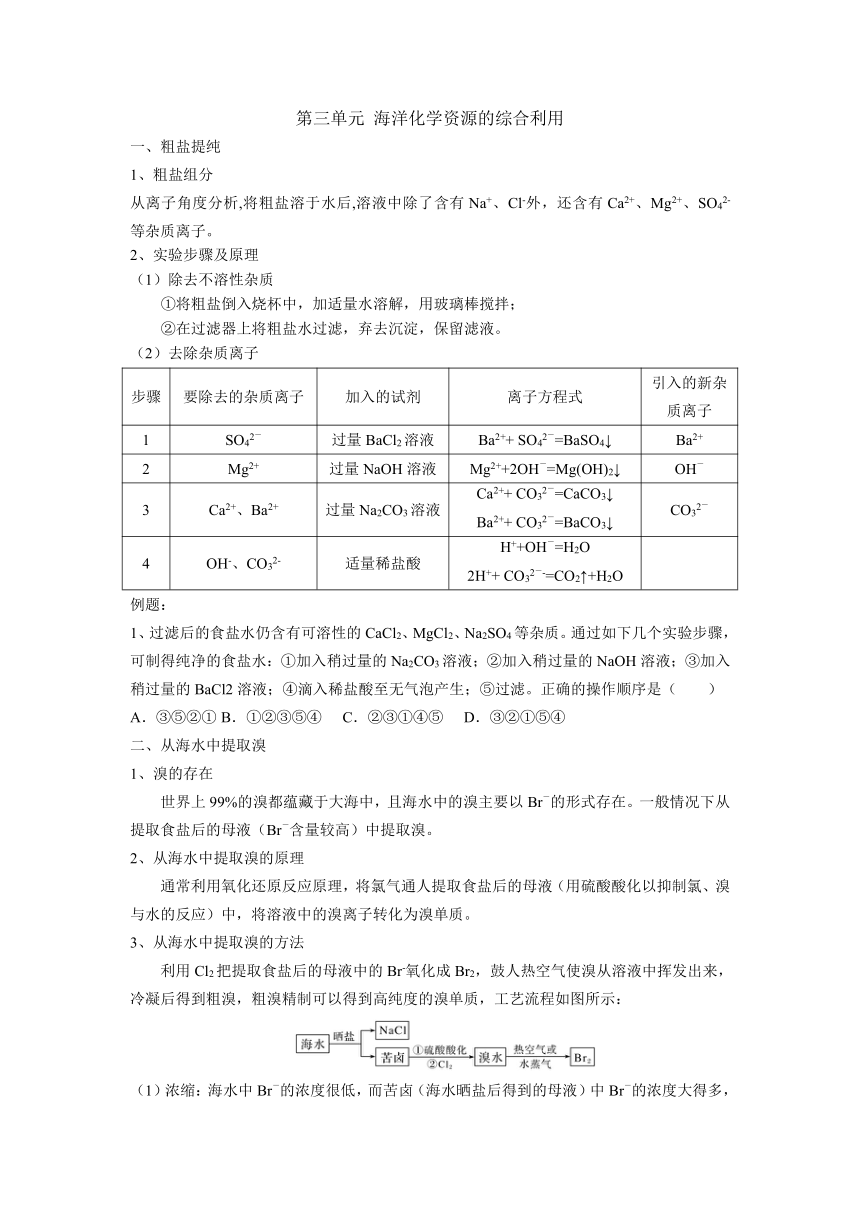
第三单元 海洋化学资源的综合利用 一、粗盐提纯 1、粗盐组分 从离子角度分析,将粗盐溶于水后,溶液中除了含有Na+、Cl-外,还含有Ca2+、Mg2+、SO42-等杂质离子。 2、实验步骤及原理 (1)除去不溶性杂质 ①将粗盐倒入烧杯中,加适量水溶解,用玻璃棒搅拌; ②在过滤器上将粗盐水过滤,弃去沉淀,保留滤液。 (2)去除杂质离子 步骤 要除去的杂质离子 加入的试剂 离子方程式 引入的新杂质离子 1 SO42- 过量BaCl2溶液 Ba2++ SO42-=BaSO4↓ Ba2+ 2 Mg2+ 过量NaOH溶液 Mg2++2OH-=Mg(OH)2↓ OH- 3 Ca2+、Ba2+ 过量Na2CO3溶液 Ca2++ CO32-=CaCO3↓ Ba2++ CO32-=BaCO3↓ CO32- 4 OH-、CO32- 适量稀盐酸 H++OH-=H2O 2H++ CO32--=CO2↑+H2O 例题: 1、过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质。通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( ) A.③⑤②① B.①②③⑤④ C.②③①④⑤ D.③②①⑤④ 二、从海水中提取溴 1、溴的存在 世界上99%的溴都蕴藏于大海中,且海水中的溴主要以Br-的形式存在。一般情况下从提取食盐后的母液(Br-含量较高)中提取溴。 2、从海水中提取溴的原理 通常利用氧化还原反应原理,将氯气通人提取食盐后的母液(用硫酸酸化以抑制氯、溴与水的反应)中,将溶液中的溴离子转化为溴单质。 3、从海水中提取溴的方法 利用Cl2把提取食盐后的母液中的Br-氧化成Br2,鼓人热空气使溴从溶液中挥发出来,冷凝后得到粗溴,粗溴精制可以得到高纯度的溴单质,工艺流程如图所示: (1)浓缩:海水中Br-的浓度很低,而苦卤(海水晒盐后得到的母液)中Br-的浓度大得多,可作提取溴的原料。 (2)氧化:将Br-转化为Br2需要加氧化剂,一般用氯气作氧化剂。 离子方程式为Cl2+2Br-===2Cl-+Br2。 (3)提取:通过上述反应,生成的溴单质依然溶解在苦卤中,利用溴的挥发性,鼓入热空气或水蒸气,就可将溴分离出来。 4、溴及其化合物的性质与应用 (1)Br2的物理性质 常温下溴单质是深红棕色密度比水大的液体,极易挥发;溴单质在水中的溶解度很小,但易溶于酒精、四氯化碳(密度比水大)等有机溶剂。 (2)Br2的化学性质 ①溴单质的氧化性强于碘单质而弱于氯气,溴单质能将碘化钾溶液中的碘置换出来:2KI+Br2=2KBr+I2 ②与氯气相似,Br2能与金属单质、H2等反应:2Fe+3Br22FeBr3,H2+Br22HBr。 ③溴有强腐蚀性。 (3)应用 ①制备药物。如消毒药剂“红药水”、镇静剂、青霉素等药物中都含有溴元素。 ②制造农业杀虫剂、阻燃剂的原料。 ③作感光剂。溴化银可用作医疗X射线胶片上的感光剂。 ④变色玻璃中通常加入适量的溴化银和氧化铜。其变色原理用化学方程式表示为2AgBr2Ag+Br2,2Ag+Br22AgBr。 例题: 1.盛放液溴的试剂瓶中要加一定量的水,其目的是( ) A.把溴溶于水得到溴水 B.将液溴与空气隔绝防止溴被氧化 C.减少液溴挥发 D.防止溴升华 (22-23莆田一中期末)2.我国有广阔的海岸线,海水的综合利用大有可为。海水中溴含量约为65mg·L-1,从海水中提取溴的工业流程如图: (1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 性。 (2)写出以上步骤Ⅱ中发生反应的离子方程式: 。 (3)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式 ;实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 。 A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯 (4)将1m3海水浓缩至1L ... ...
~~ 您好,已阅读到文档的结尾了 ~~

