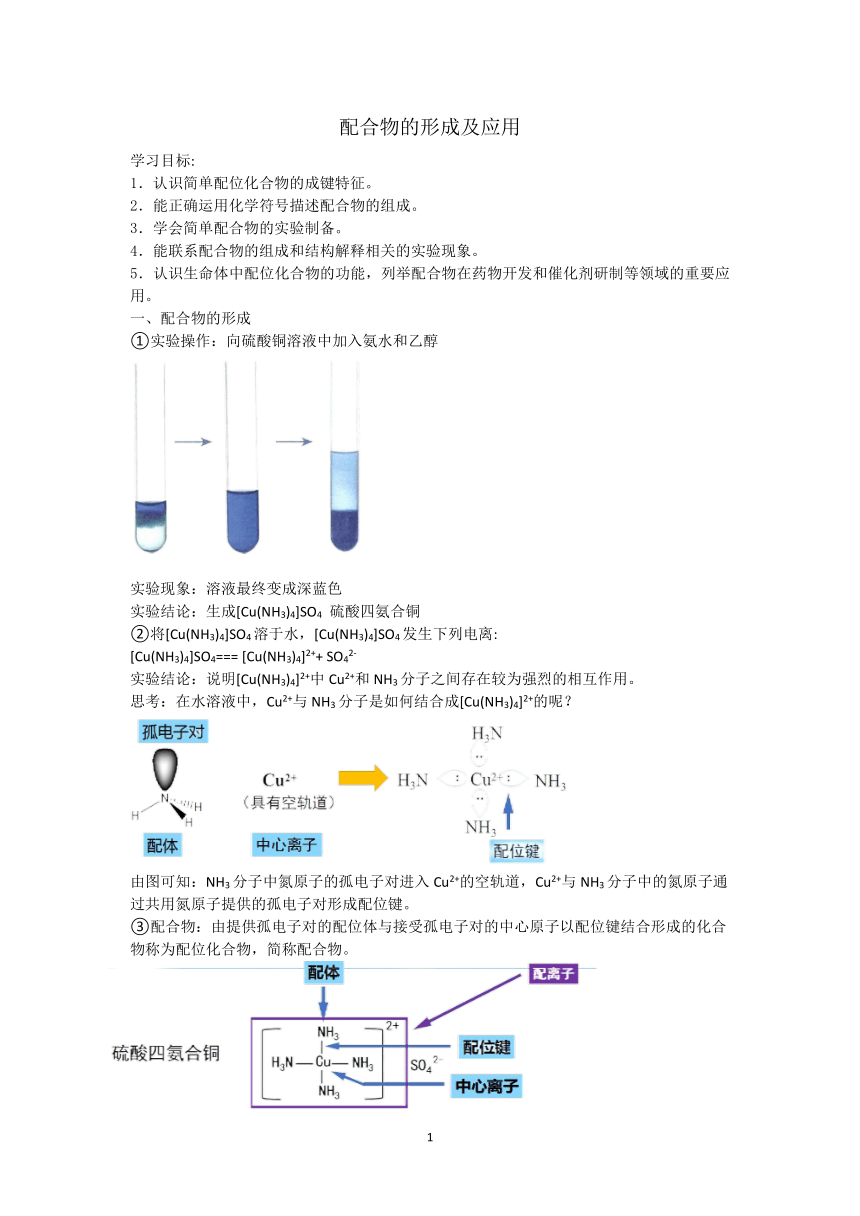
配合物的形成及应用 学习目标: 1.认识简单配位化合物的成键特征。 2.能正确运用化学符号描述配合物的组成。 3.学会简单配合物的实验制备。 4.能联系配合物的组成和结构解释相关的实验现象。 5.认识生命体中配位化合物的功能,列举配合物在药物开发和催化剂研制等领域的重要应用。 一、配合物的形成 ①实验操作:向硫酸铜溶液中加入氨水和乙醇 实验现象:溶液最终变成深蓝色 实验结论:生成[Cu(NH3)4]SO4 硫酸四氨合铜 ②将[Cu(NH3)4]SO4溶于水,[Cu(NH3)4]SO4发生下列电离: [Cu(NH3)4]SO4=== [Cu(NH3)4]2++ SO42- 实验结论:说明[Cu(NH3)4]2+中Cu2+和NH3分子之间存在较为强烈的相互作用。 思考:在水溶液中,Cu2+与NH3分子是如何结合成[Cu(NH3)4]2+的呢? 由图可知:NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。 ③配合物:由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物,简称配合物。 ④配合物的命名 1.配离子念法:配位数→配体名称→合→中心原子(离子)名称 2.配合物→类似于盐(酸、碱)的念法 注:配合物中外界中的离子能电离出来,而内界中的离子不能电离出来 例:1.[Zn(NH3)4]SO4中,Zn2+与NH3分子以配位键结合,形成配合物的内界[Zn(NH3)4]2+,SO42-为配合物的外界 Zn2+提供空轨道接受孤电子对,是中心原子;NH3分子中N原子提供孤电子对,是配位原子,NH3分子是配位体;[Zn(NH3)4]2+中,Zn2+的配位数为4。 ⑤ 配位键形成的条件: 1.一方提供孤电子对(配体) 2.一方提供空轨道 例:在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、CO、F-、CN-中 中心原子:Fe3+、Cu2+、Zn2+、Ag+ 配位体:H2O、NH3、CO、F-、CN- 注:1.中心原子(离子):提供空轨道,接受孤电子对。 通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等; 其他可提供空轨道的粒子有H+、B、Al。 2.配位体:提供孤电子对的分子或离子, 通常是含第ⅤA、ⅥA、ⅦA族元素形成的分子或离子,如NH3、CO、H2O、F-、Cl-、OH-、CN-、SCN-等。 思考:配合物一定是由内界和外界组成吗? 不一定,有的配合物没有外界。如Fe(CO)5、Fe(SCN)3。有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4 ⑥配合物的结构特点 1.配合物整体(包括内界和外界)显电中性,外界离子所带电荷总数等于配离子的电荷数。 如K3[Fe(CN)6],外界总电荷数为+3,内界为-3,又知CN-为-1价,中心原子Fe为+3价。 2.一个中心原子(离子)可同时结合多种配位体。 如[Cr(H2O)5Cl]Cl2·H2O,配位体是H2O和Cl-,配位数为6 配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。 如K3[Fe(CN)6],内界为[Fe(CN)6]3-,Fe(CO)5为电中性,没有外界。 4.对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难发生解离;内、外界之间以离子键结合,在水溶液中较易电离。 配合物 配离子 中心原子(离子) 配位原子 配位体 配位数 [Co(NH3)6]Cl3 [Cu(H2O)4]SO4 [Fe(H2O)6]2(SO4)3 [Ag(NH3)2]OH [Cu(NH3)4]SO4 ⑦配位键的表示方法:(电子对给予体)A→B(电子对接受体)或A—B 注:1.配位键是一种特殊的共价键,配位键与共价键性质完全相同。 2.配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。 3.③H3O+、NH4+中含有配位键。 ⑧判断配位键的常用方法 1.看成键原子(或离子)的特点,一方提供空轨道,另一方有孤电子对; 2.看成键原子(或离子)双方的成键能力,成键能力一般等于8-最外层电子数,或等于最外层电子数,超出成键能力的键 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

