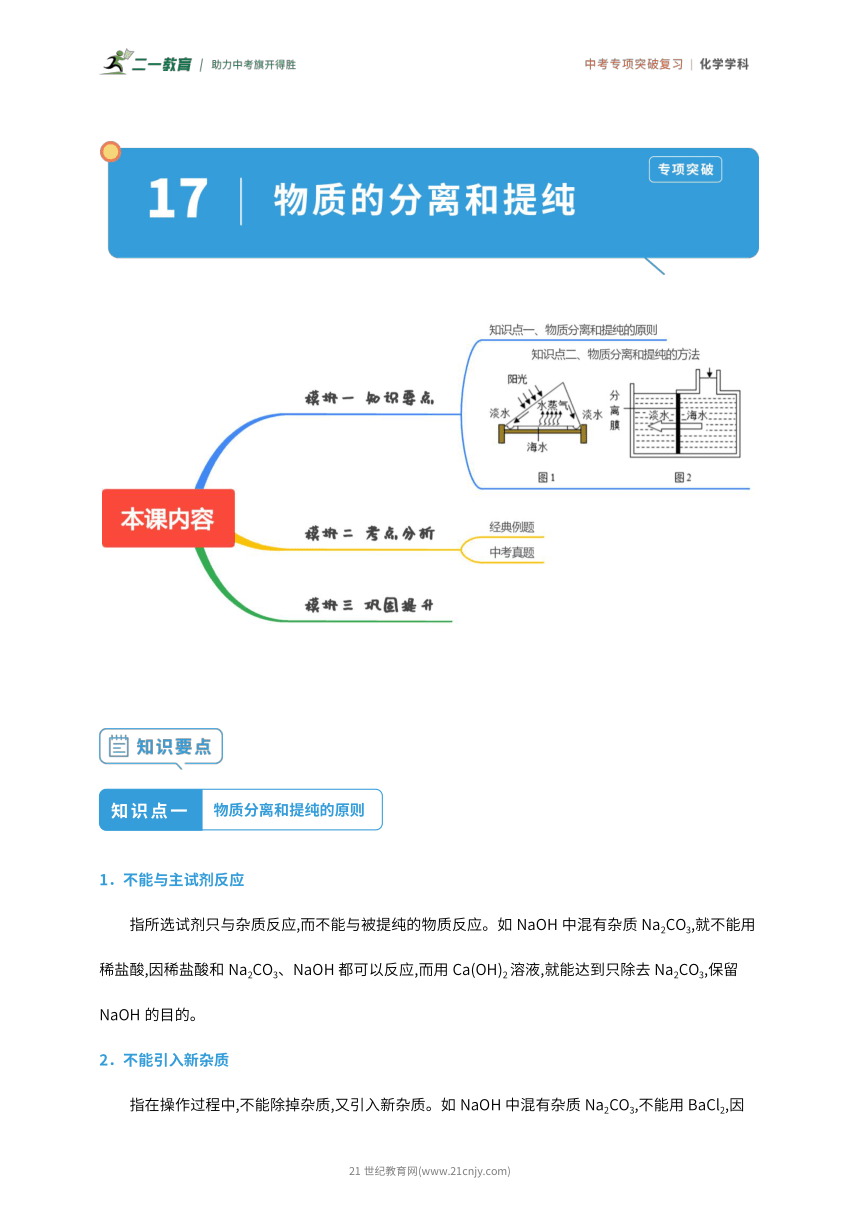
知识点一 物质分离和提纯的原则 1.不能与主试剂反应 指所选试剂只与杂质反应,而不能与被提纯的物质反应。如 NaOH 中混有杂质Na2CO3,就不能用 稀盐酸,因稀盐酸和 Na2CO3、NaOH都可以反应,而用 Ca(OH)2溶液,就能达到只除去Na2CO3,保留 NaOH 的目的。 2.不能引入新杂质 指在操作过程中,不能除掉杂质,又引入新杂质。如 NaOH中混有杂质 Na2CO3,不能用 BaCl2,因 21 世纪教育网(www.21cnjy.com) BaCl2+Na2CO3 BaCO3↓+2NaCl,会引入新杂质 NaCl。故要用 Ba(OH)2溶 液:Ba(OH)2+Na2CO3 BaCO3↓+2NaOH。 3.易分离 指操作结束之后,杂质能与主试剂分开。如 CO2中混有杂质 CO,就不能用点燃的方法,引入 O2虽与 CO反应生成 CO2,但 O2无法与 CO2分离;且 CO2量多而 CO量少时,也无法点燃。 知识点二 物质分离和提纯的方法 1.物理方法 方法 适用范围 举例 不溶固体和液体或可溶固体和不溶固体之 粗盐提纯、分离NaCl 和 CaCO3的混合物 过滤法 间的分离或提纯 蒸发结晶:溶解度受温度影响较小的物质 从含有少量 KNO3的 NaCl 中提纯 NaCl 降温结晶(冷却热饱和溶液),适用于溶解度 从含有少量NaCl 的 KNO3中提纯 KNO3 结晶法 随温度降低而明显减小的物质 升温结晶,适用于溶解度随温度升高而减小 从石灰水中分离出氢氧化钙 的物质 蒸馏法 液液混合物中各成分的沸点不同 分离酒精和水的混合物 吸附法 利用某些物质具有吸附性 活性炭可以除去水中的色素和异味 2.化学方法 (1)化气法:向混合物中加入适量的某种试剂,使其中的杂质转变为气体逸出而除去。如 KCl(K2CO3), 可加入适量的稀盐酸,将 K2CO3转化为 CO2而除去(K2CO3+2HCl 2KCl+H2O+CO2↑)。CO2中含有杂 质 CO,可通过灼热的 CuO除去 CO。 (2)化水法:向混合物中加入适量的某种试剂,使其中的杂质转变为水而除去(在通常情况下,水不算杂 21 世纪教育网(www.21cnjy.com) 质)。如 NaCl(NaOH),可加入适量的稀盐酸,将 NaOH转化为NaCl(NaOH+HCl NaCl+H2O)。 (3)沉淀法:向混合物的溶液中加入适量的某种试剂,使杂质与该试剂反应转化为沉淀,再过滤除掉沉 淀。如NaNO3(NaCl),可加入适量的硝酸银溶液,再过滤掉沉淀(NaCl+AgNO3 AgCl↓+NaNO3)。 ( 4 ) 加 热 ( 高 温 ) 法 : 加 热 ( 高 温 ) 混 合 物 使 杂 质 分 解 ( 或 变 成 气 体 ) 而 除 去 。 如 CaO(CaCO3),CaCO3 CaO+CO2↑。 (5)溶解法:向混合物中加入某种试剂,使杂质与试剂反应而被溶解掉,以除去杂质。 如 Cu(CuO),CuO+H2SO4 CuSO4+H2O。 (6)置换法:向混合物中加入一种试剂,利用该试剂与杂质发生置换反应,而将杂质除去。 如 FeSO4(CuSO4),CuSO4+Fe FeSO4+Cu。 (7)吸收法:将气体混合物通过洗气装置,杂质气体被装置内所盛试剂吸收而除去。如: ① 水蒸气,可用浓硫酸来吸收。 ② 酸性气体(CO2、SO2、HCl 等),可用碱溶液(NaOH 溶液)吸收。 ③ 碱性气体(NH3等),可用酸溶液(H2SO4溶液)吸收。 考点一 混合物的分离方法 1.(2023 南平模拟)《本草纲目》中“黄连”条目下记载:“吐血不止,取黄连一两,捣碎,加 鼓二十粒,水煎去渣,温服。”该过程中没有涉及的操作是( ) A.加热 B.称量 C.过滤 D.蒸发结晶 【解答】解:取黄连一两,捣碎,水煎去渣,温服,含有称量、加热、过滤操作, 故选:D。 2.(2023 威海模拟)海水淡化常用太阳能蒸馏和膜分离等方法,根据图示回答问题。 21 世纪教育网(www.21cnjy.com) (1)太阳能蒸馏的原理如上图图 1所示。太阳能蒸馏属于 物理 (物理/化学)变化。太阳能 蒸馏淡化的优点是 节约能源或环保 。 (2)膜分离的原理上图如图 2所示。将海水加压,水分子能透过分离膜,Na+和 Cl﹣却不能透过, 一段时间后,右侧海水中氯化钠的质量分数 变大 (变大/变小/不变)。膜分离的原理与化学 实验中物质分离的 过 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

