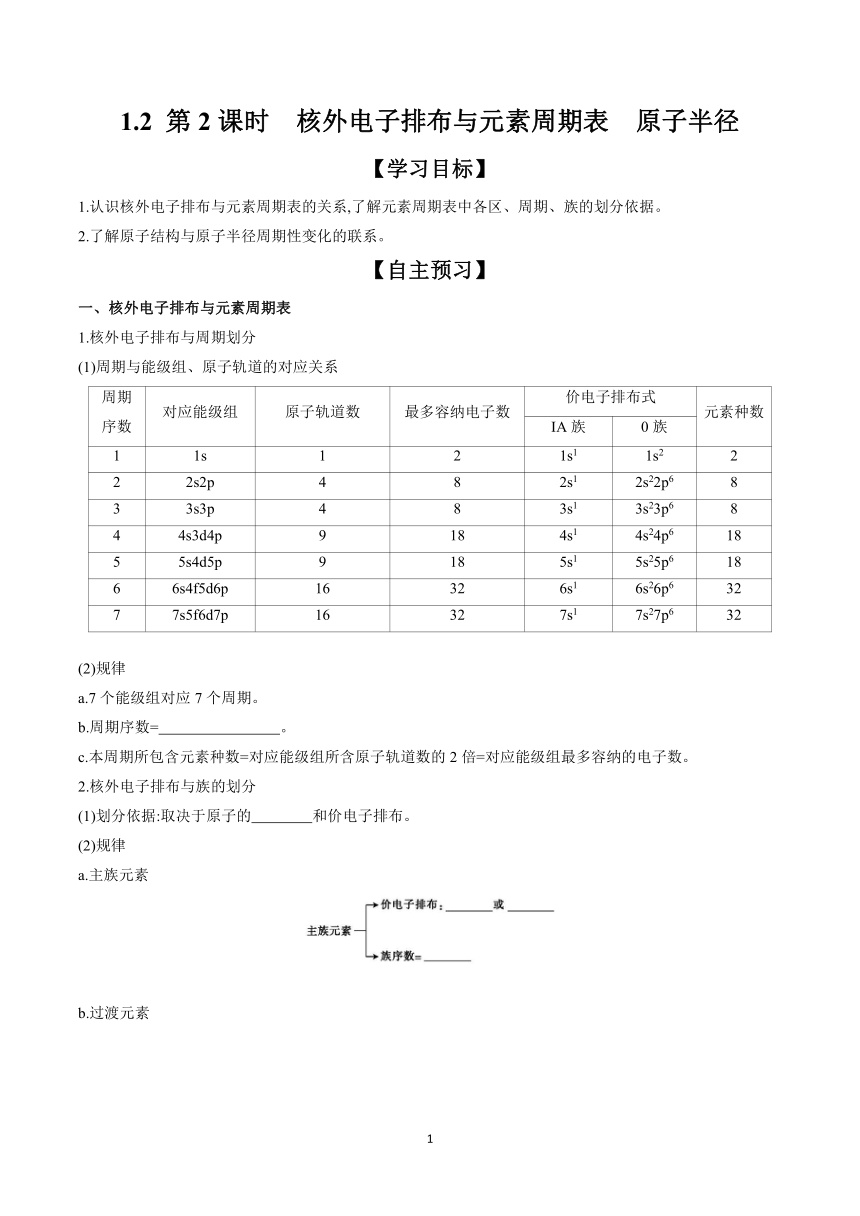
1.2 第2课时 核外电子排布与元素周期表 原子半径 【学习目标】 1.认识核外电子排布与元素周期表的关系,了解元素周期表中各区、周期、族的划分依据。 2.了解原子结构与原子半径周期性变化的联系。 【自主预习】 一、核外电子排布与元素周期表 1.核外电子排布与周期划分 (1)周期与能级组、原子轨道的对应关系 周期 序数 对应能级组 原子轨道数 最多容纳电子数 价电子排布式 元素种数 ⅠA族 0族 1 1s 1 2 1s1 1s2 2 2 2s2p 4 8 2s1 2s22p6 8 3 3s3p 4 8 3s1 3s23p6 8 4 4s3d4p 9 18 4s1 4s24p6 18 5 5s4d5p 9 18 5s1 5s25p6 18 6 6s4f5d6p 16 32 6s1 6s26p6 32 7 7s5f6d7p 16 32 7s1 7s27p6 32 (2)规律 a.7个能级组对应7个周期。 b.周期序数= 。 c.本周期所包含元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。 2.核外电子排布与族的划分 (1)划分依据:取决于原子的 和价电子排布。 (2)规律 a.主族元素 b.过渡元素 c.稀有气体→价电子排布: ( 除外) 3.元素周期表的分区 (1)根据核外电子排布 根据核外电子排布,可把周期表里的元素划分成5个区:s区、p区、d区、ds区和f区。除ds区外,区的名称来自最后填入电子的能级的符号。 (2)根据元素金属性与非金属性 4.金属元素与非金属元素在元素周期表中的位置 (1)金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。 (2)处于d区、ds区和f区的元素全部是金属元素。s区的元素除氢外,也全部是金属元素。 二、核外电子排布与原子半径 1.原子半径 (1)定义:依据量子力学理论,人们假定原子是一个 ,并用统计的方法来测定它的半径。 (2)影响因素 2.原子半径的周期性变化 (1)同周期(稀有气体元素除外) a.规律:原子半径自左至右逐渐 。 b.原因:增加的电子所产生的电子间的 小于核电荷数增加导致的核对外层电子的 。 (2)同主族 a.规律:原子半径自上而下逐渐 。 b.原因:电子层数依次增加,电子间的 的影响大于核对外层电子的 的影响。 (3)过渡元素 a.规律:从总的变化趋势来看,从左到右原子半径的变化幅度 。 b.原因:增加的电子都分布在 轨道上,电子间的 与核对外层电子的 大致相当。 【参考答案】一、1.最外层电子所在轨道的电子层数 2.价电子数目 ns1~2 ns2np1~5 价电子数 (n-1)d1~10ns1~2 价电子数 ns电子数 ns2np6 He 二、1.球体 增大 越小 2.减小 排斥作用 吸引作用 增大 排斥作用 吸引作用 不大 (n-1)d 排斥作用 吸引作用 【效果检测】 1.判断正误(正确的打“√”,错误的打“×”)。 (1)元素原子的价层电子就是最外层电子。 ( ) (2)除氦外,0族元素原子的价电子排布为ns2np6。 ( ) (3)最外层电子排布式为ns1或ns2的元素一定为金属元素。 ( ) (4)价电子排布为4s24p3的元素位于第4周期ⅤA族,是p区元素。 ( ) (5)在元素周期表中,s区、d区和ds区的元素都是金属元素。 ( ) (6)元素周期表有7个横行,即7个周期;有18个纵列,即18个族。 ( ) (7)每一周期都是碱金属元素开始,稀有气体元素结束。 ( ) 【答案】(1)× (2)√ (3)× (4)√ (5)× (6)× (7)× 2.元素周期表中周期的划分与原子结构的哪部分有关 【答案】与原子的电子层数有关。 3.除氦外,0族价电子排布有何特点 【答案】除氦外,0族最外层均有8个电子,价电子排布为ns2np6。 4.主族元素从左到右价电子排布有何特点 【答案】主族元素从左到右价电子排布从ns1~ns2np5。 5.元素周期表划分区的依据是什么 【答案】依据是原子的价电 ... ...
~~ 您好,已阅读到文档的结尾了 ~~