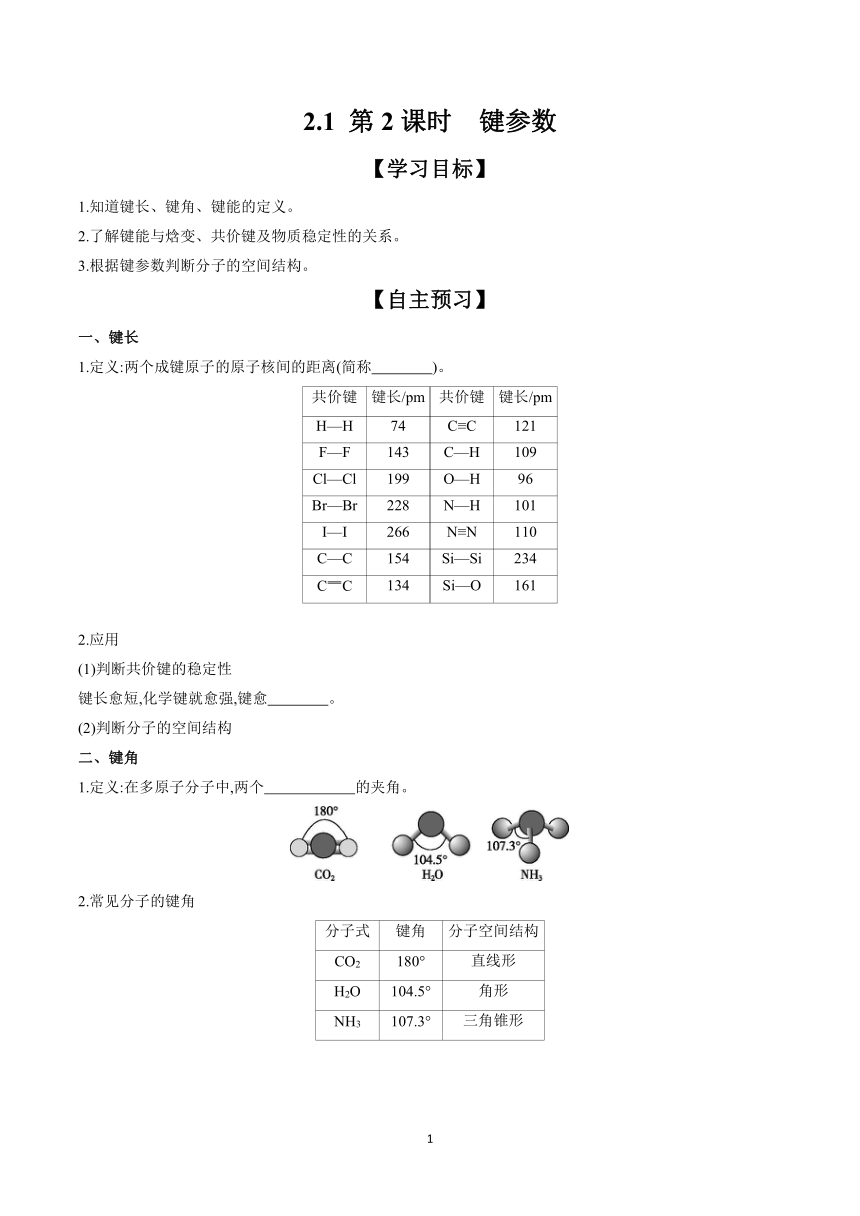
2.1 第2课时 键参数 【学习目标】 1.知道键长、键角、键能的定义。 2.了解键能与焓变、共价键及物质稳定性的关系。 3.根据键参数判断分子的空间结构。 【自主预习】 一、键长 1.定义:两个成键原子的原子核间的距离(简称 )。 共价键 键长/pm 共价键 键长/pm H—H 74 C≡C 121 F—F 143 C—H 109 Cl—Cl 199 O—H 96 Br—Br 228 N—H 101 I—I 266 N≡N 110 C—C 154 Si—Si 234 CC 134 Si—O 161 2.应用 (1)判断共价键的稳定性 键长愈短,化学键就愈强,键愈 。 (2)判断分子的空间结构 二、键角 1.定义:在多原子分子中,两个 的夹角。 2.常见分子的键角 分子式 键角 分子空间结构 CO2 180° 直线形 H2O 104.5° 角形 NH3 107.3° 三角锥形 3.意义:键角可反映分子的空间结构,是描述分子结构的重要参数,多原子分子的键角一定,表明共价键具有 。 三、键能 1.定义:在 条件下,断开 AB(g)分子中的化学键,使其分别生成 A原子和 B原子所吸收的能量称为A—B键的键能。键能的单位是 。 2.应用 (1)判断共价键的稳定性 从键能的定义可知,键能愈大,断开时需要能量愈多,这个化学键愈 。 (2)判断分子的稳定性 一般来说,结构相似的分子中,共价键的键能愈大,分子越 。如分子的稳定性:HF HCl,HBr HI。 (3)估算化学反应的反应热 同一化学键解离成气态原子所吸收的能量与气态原子结合形成化学键所释放的能量在数值上是相等的,故根据化学键的键能数据可计算化学反应的反应热,即ΔH= 。 【参考答案】一、1.核间距 2.牢固 二、1.化学键 3.方向性 三、1.01×105 Pa、298 K 1 mol 气态 气态 kJ·mol-1 2.牢固 稳定 > > 反应物中化学键键能之和-反应产物中化学键键能之和 【效果检测】 1.判断正误(正确的打“√”,错误的打“×”)。 (1)原子轨道在空间都具有方向性。 ( ) (2)σ键是轴对称而π键是镜像对称。 ( ) (3)键长的大小与成键原子的半径和成键数目有关。 ( ) (4)键能越大,键长越长,共价化合物越稳定。 ( ) (5)在分子中,两个原子间的距离叫键长。 ( ) (6)非极性键的键能大于极性键的键能。 ( ) (7)键能越大,表示该分子越容易受热分解。 ( ) (8)H—Cl键的键能为431 kJ·mol-1,H—I键的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定。( ) 【答案】(1)× (2)√ (3)√ (4)× (5)× (6)× (7)× (8)√ 2.三个键参数中,有哪几种决定化学键的稳定性 【答案】键能和键长。 3.如何判断键能大小 【答案】一般来说,键长越短,键能越大,即成键原子间的核间距越短或成键原子的原子半径越小,键能越大。 【合作探究】 任务1:键能及其应用 情境导入 1.说起温室气体,大家最先想到的是二氧化碳。其实还有一个比二氧化碳影响更大的气体———甲烷。有研究证明,以单位分子数而言,甲烷导致温室效应的效果相当于二氧化碳的25倍。 2.硅烷在常温下是一种无色、能与空气反应、并会引起窒息的气体。该气体通常与空气接触会引起燃烧并放出很浓的白色的无定型二氧化硅烟雾。 问题生成 碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实: 化学键 C—C C—H C—O Si—Si Si—H Si—O 键能/ (kJ·mol-1) 347 413 358 226 323 368 1.通常条件下,比较CH4和SiH4的稳定性谁强谁弱 【答案】因为C—H键的键能大于Si—H键的键能,所以CH4比SiH4稳定。 2.硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是什么 【答案】C—C键和C—H键的键能比Si—H键和Si—Si键的键能都大,因此烷烃比较稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以 ... ...
~~ 您好,已阅读到文档的结尾了 ~~