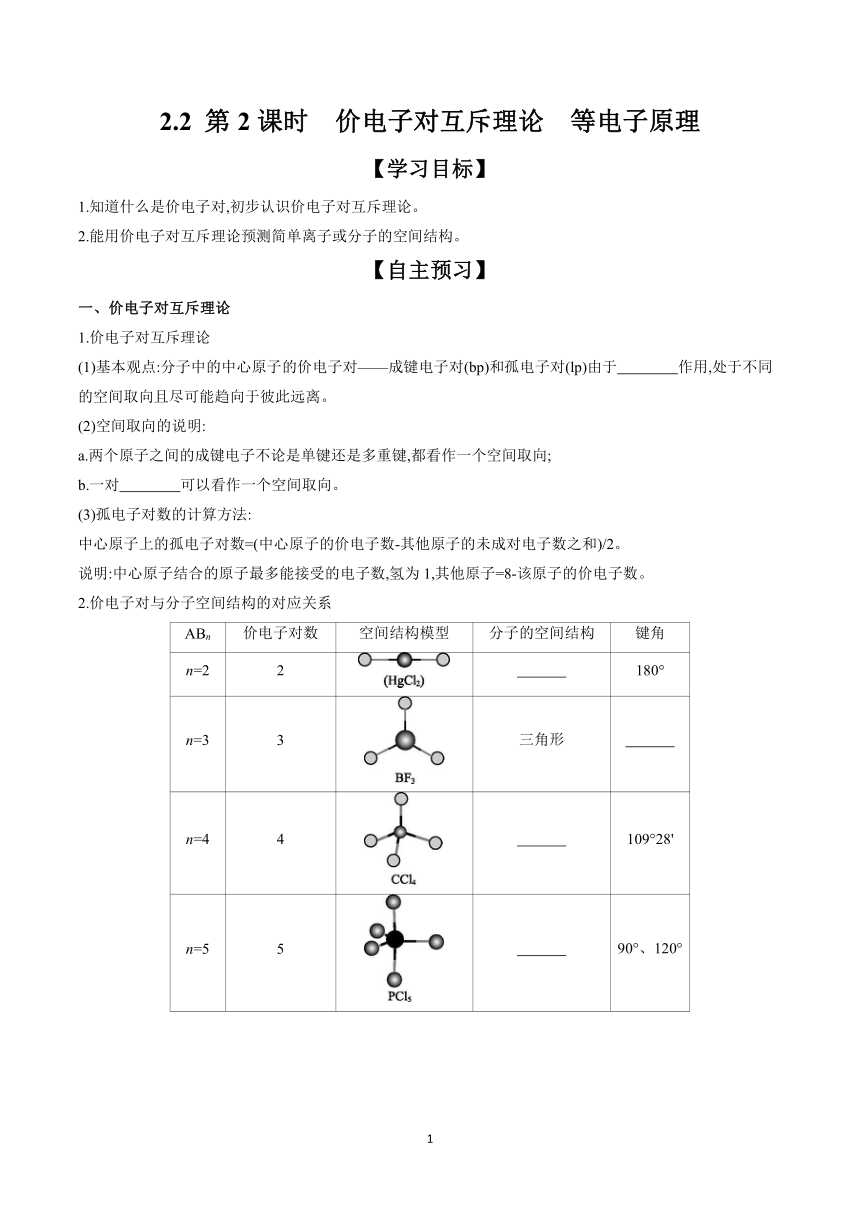
2.2 第2课时 价电子对互斥理论 等电子原理 【学习目标】 1.知道什么是价电子对,初步认识价电子对互斥理论。 2.能用价电子对互斥理论预测简单离子或分子的空间结构。 【自主预习】 一、价电子对互斥理论 1.价电子对互斥理论 (1)基本观点:分子中的中心原子的价电子对———成键电子对(bp)和孤电子对(lp)由于 作用,处于不同的空间取向且尽可能趋向于彼此远离。 (2)空间取向的说明: a.两个原子之间的成键电子不论是单键还是多重键,都看作一个空间取向; b.一对 可以看作一个空间取向。 (3)孤电子对数的计算方法: 中心原子上的孤电子对数=(中心原子的价电子数-其他原子的未成对电子数之和)/2。 说明:中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。 2.价电子对与分子空间结构的对应关系 ABn 价电子对数 空间结构模型 分子的空间结构 键角 n=2 2 180° n=3 3 三角形 n=4 4 109°28' n=5 5 90°、120° n=6 6 90° 二、等电子原理 1.基本观点: 相同且 相等的分子或离子具有相同的 和相同的 等结构特征。 2.应用举例 利用等电子原理可以推断一些简单分子或原子团的空间结构。 (1)CO、CN-与N2互为等电子体,则CO的结构式为 ,CN-的结构式为 。 (2)CS2与CO2互为等电子体,则CS2的结构式为 ,碳原子的杂化类型为 ,分子空间结构为 。 (3)N、C、SO3与BF3互为等电子体,则它们的空间结构为 。 (4)PH3、AsH3、H3O+等与NH3互为等电子体,它们的空间结构为 。 (5)S、P、Si与CCl4互为等电子体,它们的空间结构为 。 【参考答案】一、1.(1)相互排斥 (2)孤电子对 2.直线形 120° 四面体形 三角双锥形 八面体形 二、1.化学通式 价电子总数 空间结构 化学键类型 2.(1)C≡O [C≡N]- (2)SCS sp 直线形 (3)三角形 (4)三角锥形 (5)正四面体形 【效果检测】 1.判断正误(正确的打“√”,错误的打“×”)。 (1)CH2Cl2分子只有一种,可说明CH4的空间结构为正四面体形。 ( ) (2)根据价电子对互斥理论,H3O+的空间结构为平面正三角形。 ( ) (3)SO2分子与CO2分子的组成相似,故它们都是直线形分子。 ( ) (4)分子的VSEPR模型与分子的空间结构一定一致。 ( ) (5)当中心原子上无孤电子对时,分子的VSEPR模型与分子的空间结构一致。 ( ) (6)NH3分子中心原子孤电子对数为0,空间结构为三角锥形,键角为107.3°。 ( ) (7)正四面体结构的分子中键角一定是109°28'。 ( ) 【答案】(1)√ (2)× (3)× (4)× (5)√ (6)× (7)× 2.H2O分子与CO2分子、NH3分子与BF3分子,这两组分子中的原子个数相同,为何空间结构不同 【答案】H2O和NH3中心原子上的孤电子对也要占据中心原子周围的空间,并参与相互排斥。因而H2O分子呈角形,NH3分子呈三角锥形。而CO2和BF3中心原子上无孤电子对,分子的空间结构与杂化轨道模型相同,分别为直线形和平面三角形。 3.科学家研制出有望成为高效火箭推进剂的N(NO2)3,其结构如图所示,已知该分子中N—N—N键角都是108.1°。 试推测四个氮原子围成的空间是正四面体形吗 【答案】不是;由于N—N—N键角都是108.1°。所以四个氮原子围成的空间不是正四面体形,而是三角锥形。 4.VSEPR模型与空间结构之间有什么关系 【答案】价电子对互斥理论说明的是价电子对的空间结构,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对。①当中心原子无孤电子对时,两者的空间结构一致;②当中心原子有孤电子对时,两者的空间结构不一致。 【合作探究】 任务1:价电子对互斥理论及其应用 情境导入 二氧化硫是工业上制取硫酸的中间产物,也是化石燃料燃烧过程 ... ...
~~ 您好,已阅读到文档的结尾了 ~~