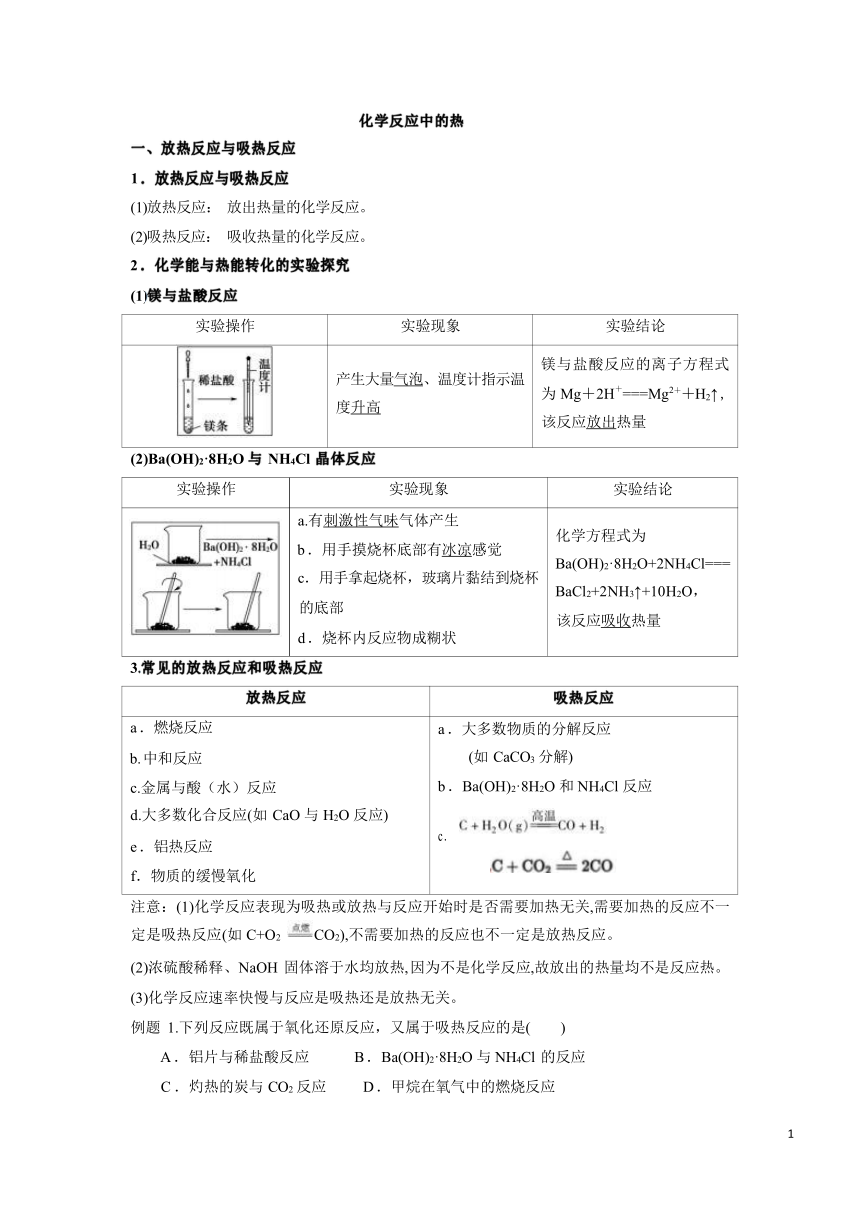
化学反应中的热 一、放热反应与吸热反应 1 .放热反应与吸热反应 (1)放热反应: 放出热量的化学反应。 (2)吸热反应: 吸收热量的化学反应。 2 .化学能与热能转化的实验探究 (1)镁与盐酸反应 实验操作 实验现象 实验结论 产生大量气泡、温度计指示温 度升高 镁与盐酸反应的离子方程式 为 Mg+2H+===Mg2++H2↑ , 该反应放出热量 (2)Ba(OH)2·8H2O 与 NH4Cl 晶体反应 实验操作 实验现象 实验结论 a.有刺激性气味气体产生 b .用手摸烧杯底部有冰凉感觉 c.用手拿起烧杯,玻璃片黏结到烧杯 的底部 d .烧杯内反应物成糊状 化学方程式为 Ba(OH)2·8H2O+2NH4Cl=== BaCl2+2NH3↑+10H2O, 该反应吸收热量 3.常见的放热反应和吸热反应 放热反应 吸热反应 a .燃烧反应 b. 中和反应 c.金属与酸(水)反应 d.大多数化合反应(如 CaO 与 H2O 反应) e .铝热反应 f.物质的缓慢氧化 a .大多数物质的分解反应 (如 CaCO3 分解) b .Ba(OH)2·8H2O 和 NH4Cl 反应 c . 注意:(1)化学反应表现为吸热或放热与反应开始时是否需要加热无关,需要加热的反应不一 定是吸热反应(如 C+O2 CO2),不需要加热的反应也不一定是放热反应。 (2)浓硫酸稀释、NaOH 固体溶于水均放热, 因为不是化学反应,故放出的热量均不是反应热。 (3)化学反应速率快慢与反应是吸热还是放热无关。 例题 1.下列反应既属于氧化还原反应,又属于吸热反应的是( ) A .铝片与稀盐酸反应 B .Ba(OH)2·8H2O 与 NH4Cl 的反应 C .灼热的炭与 CO2 反应 D .甲烷在氧气中的燃烧反应 1 二、热化学方程式 1 .概念 能表示参加反应物质的量和反应热的关系的化学方程式。 2 .书写热化学方程式的注意事项 (1)ΔH 只能写在标有反应物和生成物状态的化学方程式的右边,并用“空格” 隔开。若 为放热反应,ΔH 为“ - ; 若为吸热反应, ΔH 为“ +” 。ΔH 的单位是 J/mol 或 kJ/mol。 (2)由于 ΔH 与测定条件有关(压强对反应的焓变影响很小),因此应在 ΔH 后注明反应 温度(若不注明, 则表示在 25 ℃下测定),因为在不同温度下进行同一反应时,反应的焓变 是不同的。 (3)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表 示该物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。 (4)要在物质的化学式后面用括号注明参加反应的物质的聚集状态,一般用英文字母 g、 l 和 s 分别表示物质的气态、液态和固态, 溶液则用 aq 表示。 (5)根据焓的性质,若热化学方程式中各物质的化学计量数加倍,则 ΔH 的数值也加倍; 若反应逆向进行,则 ΔH 改变符号, 但绝对值不变。 (6)对于可逆反应,ΔH 的值为其反应物完全转化为生成物时的量,例如 2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ/mol ,ΔH 表示的意义是 2 mol SO2 气体和 1 mol O2 气体完全反应 生成 2 mol SO3 气体时放出的热量为 Q kJ。但是 2 mol SO2 气体和 1 mol O2 气体在实际反应 时放出的热量要小于 Q kJ,因为 2 mol SO2 气体和 1 mol O2 气体不可能完全转化为 SO3。 3 .意义 热化学方程式不仅表示化学反应中的物质变化,也表明了能量变化。 H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ/mol,表示在 25_℃和 101_kPa 条件下,1_mol H2(g) 与 mol O2(g)完全反应生成 1_mol H2O(l)时放出热量 285.8 kJ 例题 1.已知 0.3 mol 的气态高能燃料乙硼烷(B2H6)在 O2 中燃烧,生成固态三氧化二硼和液态 水,放出 649.5 kJ 的热量,其热化学方程式为 。 ( 2. 化学反应 N 2 + 3H 2 )2NH3 的能量变化如下图所示, 该反应的热化学方程式是( ) ( 2NH 3 (l) Δ H = 2( a - b - c ) kJ/mol 2NH 3 (g) Δ H = 2( b - a ) kJ/mol NH 3 (l) Δ H = 2( b + c - a ) kJ/mol NH 3 (g) Δ H = 2( a + b ) kJ/mol )A ... ...
~~ 您好,已阅读到文档的结尾了 ~~

