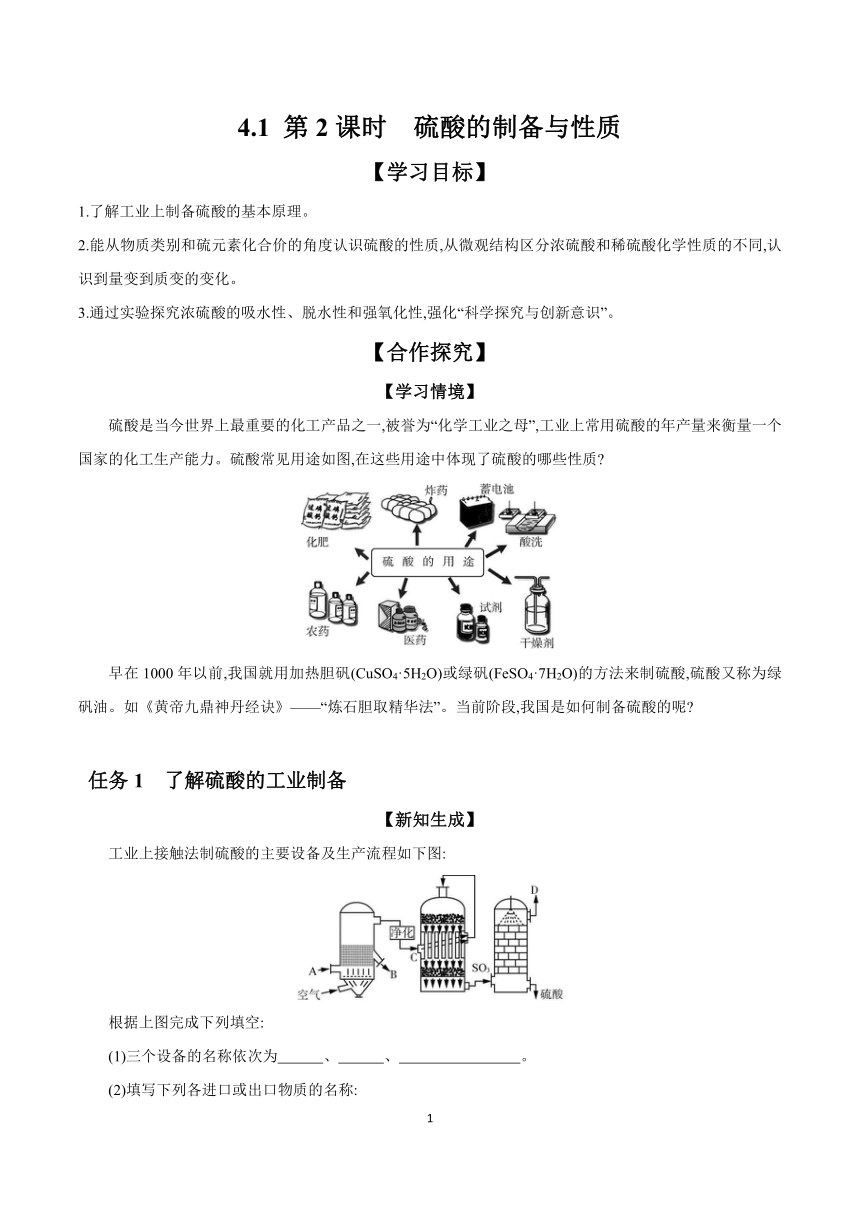
4.1 第2课时 硫酸的制备与性质 【学习目标】 1.了解工业上制备硫酸的基本原理。 2.能从物质类别和硫元素化合价的角度认识硫酸的性质,从微观结构区分浓硫酸和稀硫酸化学性质的不同,认识到量变到质变的变化。 3.通过实验探究浓硫酸的吸水性、脱水性和强氧化性,强化“科学探究与创新意识”。 【合作探究】 【学习情境】 硫酸是当今世界上最重要的化工产品之一,被誉为“化学工业之母”,工业上常用硫酸的年产量来衡量一个国家的化工生产能力。硫酸常见用途如图,在这些用途中体现了硫酸的哪些性质 早在1000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制硫酸,硫酸又称为绿矾油。如《黄帝九鼎神丹经诀》———�炼石胆取精华法”。当前阶段,我国是如何制备硫酸的呢 任务1 了解硫酸的工业制备 【新知生成】 工业上接触法制硫酸的主要设备及生产流程如下图: 根据上图完成下列填空: (1)三个设备的名称依次为 、 、 。 (2)填写下列各进口或出口物质的名称: A (如 );B ;C ;D 。 (3)三个设备中发生的化学反应依次是 ; ; 。 (4)吸收SO3时用 防止 。 【答案】沸腾炉 接触室 吸收塔 含硫矿石 硫黄或硫铁矿(FeS2) 炉渣 二氧化硫、氧气 尾气(SO2、O2) S+O2SO2或4FeS2+11O28SO2+2Fe2O3 2SO2+O22SO3 SO3+H2OH2SO4 98.3%的浓硫酸 形成酸雾 【核心突破】 典例1 在硫酸的工业制法中,下列生产操作和说明生产操作的主要原因都正确的是( )。 A.硫铁矿燃烧前要粉碎,因为大块硫铁矿不能燃烧 B.从沸腾炉出来的气体需净化,因为炉气中的SO2会与杂质反应 C.SO2氧化成SO3,SO2能全部转化为SO3 D.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全 【答案】D 归纳总结 化学工业制备的要求 1.原料廉价且稳定,降低运输成本。 2.保证反应物在反应中能充分接触。 3.制备流程简单高效,能耗低,反应放出的热量尽可能加以循环利用,生成副产物较少。 4.制备过程绿色、环保,没有使用或生成对环境有害的物质。 训练1 工业上制硫酸的设备分为三大部分,一是沸腾炉,二是接触室,三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,三氧化硫与水化合形成硫酸。为研究吸收三氧化硫应选用的物质,依照工业上制备硫酸的流程设计了下面的实验装置。 下列有关叙述不正确的是( )。 A.装置甲的作用仅仅是用于干燥气体 B.反应中要求乙反应器内氧气的物质的量要比二氧化硫的物质的量多一倍左右,该装置能够通过现象判断 C.实验时丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直都没有任何现象,说明浓硫酸的吸收效果比水好 D.该实验装置存在明显的缺陷 【答案】A 【解析】装置甲的作用有:①干燥二氧化硫和氧气,吸收水分,②使二氧化硫和氧气充分混合,③通过观察气泡,调节气体的流速,A项错误;甲装置中,通过控制通氧气的导管口产生气泡的速率大约是通二氧化硫导管口的2倍,可以保证气体的体积比,能够通过现象判断,B项正确;由实验现象可说明浓硫酸的吸收效果比水好,C项正确;SO2和SO3都是大气污染物,必须进行尾气吸收,D项正确。 任务2 探究浓硫酸的性质 【新知生成】 浓硫酸的三大特性 1.吸水性:浓硫酸能够吸收 或其他物质中的 分子,常被用作 。 2.脱水性:浓硫酸能够按照原子个数比 夺取某些有机物中的氢、氧元素形成 分子。 3.强氧化性 (1)能与绝大多数金属发生反应,与铜反应的化学方程式为 。 (2)常温下, 、 等少数金属遇到浓硫酸 ... ...
~~ 您好,已阅读到文档的结尾了 ~~