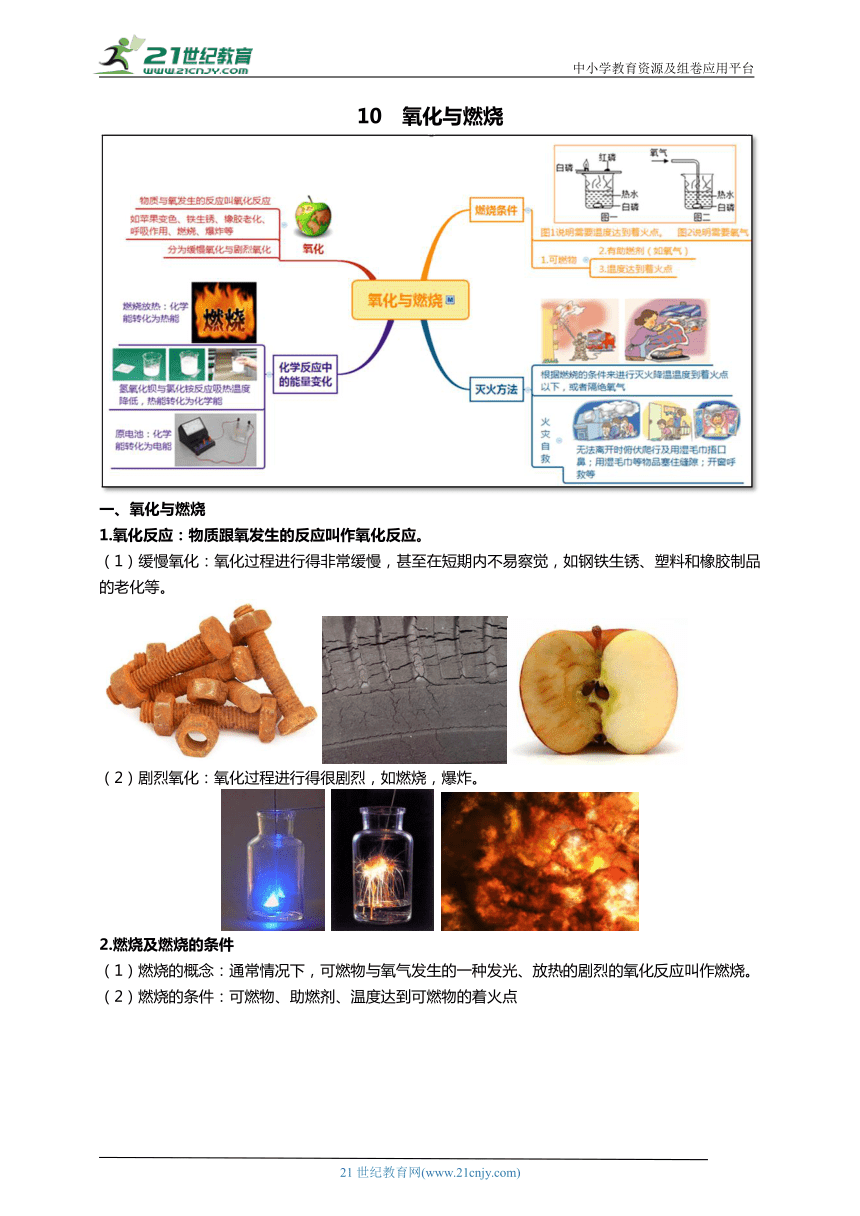
中小学教育资源及组卷应用平台 10 氧化与燃烧 一、氧化与燃烧 1.氧化反应:物质跟氧发生的反应叫作氧化反应。 (1)缓慢氧化:氧化过程进行得非常缓慢,甚至在短期内不易察觉,如钢铁生锈、塑料和橡胶制品的老化等。 (2)剧烈氧化:氧化过程进行得很剧烈,如燃烧,爆炸。 2.燃烧及燃烧的条件 (1)燃烧的概念:通常情况下,可燃物与氧气发生的一种发光、放热的剧烈的氧化反应叫作燃烧。 (2)燃烧的条件:可燃物、助燃剂、温度达到可燃物的着火点 (3)可燃物的着火点:物质燃烧所需达到的最低温度叫着火点 不同物质的着火点是不同的。 物质 白磷 红磷 汽油 木材 木炭 硫 酒精 无烟煤 着火点℃ 40 240 250 250~330 320-370 260 558 700-750 可燃物在空气中燃烧和在氧气中燃烧的异同点: ①本质一样,都是与氧气发生反应;②现象不一样,在氧气中燃烧剧烈一些 原因:反应物接触面越大,浓度越大,反应越剧烈 (5)自燃:由于缓慢氧化产生的热量被积累后,温度升高达到该可燃物的着火点时,在氧气充足的情况下,不经点火就自发燃烧起来的现象 (6)爆炸:如果燃烧以极快的速率在有限的空间里发生,瞬间内累积大量的热,使气体体积急剧地膨胀,就会引起爆炸。 化学变化:鞭炮 (另外一种需要分清楚的爆炸:高压锅爆炸,轮胎爆胎属于物理变化) 3. 灭火 破坏燃烧的三个条件之一,就可以达到灭火的目的。 (1)清除可燃物或使可燃物与火源隔离 (2)隔绝空气(或氧气) (3)使可燃物的温度降到着火点以下 促进燃烧:(1)增大氧气的浓度 (氧气的浓度越大燃烧越剧烈) (2)增大可燃物和氧气的接触面积 (接触面积越大燃烧越剧烈) 4. 化学反应中的能量变化 化学反应在生成新物质的同时,伴有能量的变化,而能量的变化通常表现为热量的变化,即有放热现象或吸热现象。 (1)放出热量的反应:如燃料的燃烧,生石灰与水结合成氢氧化钙,镁与盐酸反应等。 吸收热量的反应:如碳与二氧化碳在高温条件下生成CO,Ba(OH)2与NH4Cl反应。 二、质量守恒定律 1.质量守恒定律的概念:在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。 2.化学反应的过程就是组成反应物分子的原子重新组合 成生成物分子的过程。 3.化学反应前后原子的 种类 和 数目 不变,所以化学反应前后物质的质量总和必然相等。而物质的 分子数和物态可能改变。 硫 + 氧气二氧化硫 注:a.质量守恒定律的适用范围是化学变化,一切化学反应都符合该定律。 b.反应物的质量总和只包括参与部分,不包括反应物过量部分的质量及不参加反应的杂质的质量。 c.验证质量守恒定律时,对于有气体参加或生成的反应,一定要在密闭容器内进行实验。 d.化学反应前后的变与不变 六个一定 不变 宏观 元素的种类不变 元素的质量不变 反应物和生成物的总质量不变 微观 原子的种类不变 原子的数目不变 原子的质量不变 两个一定 改变 宏观 物质的种类一定改变 微观 分子的种类一定改变 两个可能 改变 宏观 物质的物态(或元素的化合价)可能改变 微观 分子的数目可能改变 四、典型例题 (一)考点:氧化与燃烧 【例1】(2022杭州期末)下列说法不正确的是( ) A.切开的苹果放一段时间会变黄是因为和空气中的氧气发生了缓慢氧化 B.镁带在空气中剧烈燃烧,发出耀眼的白光,发生的反应属于氧化反应 C.可燃物必须遇到氧气,且温度达到着火点才可以燃烧 D.若炒菜时油锅着火,则可以放入切好的蔬菜或者盖上锅盖来灭火 【例2】(2022浙江专题)分析推理是科学学习过程中的常用方法,下列推理正确的是 ( ) A.自燃是由缓慢氧化引起的,缓慢氧化一定能引起自燃 B.化合物是含有不同种元素的纯净物,含有不同种元素的纯净物一定是化合物 C.物质和氧气发生的反应是氧化 ... ...
~~ 您好,已阅读到文档的结尾了 ~~