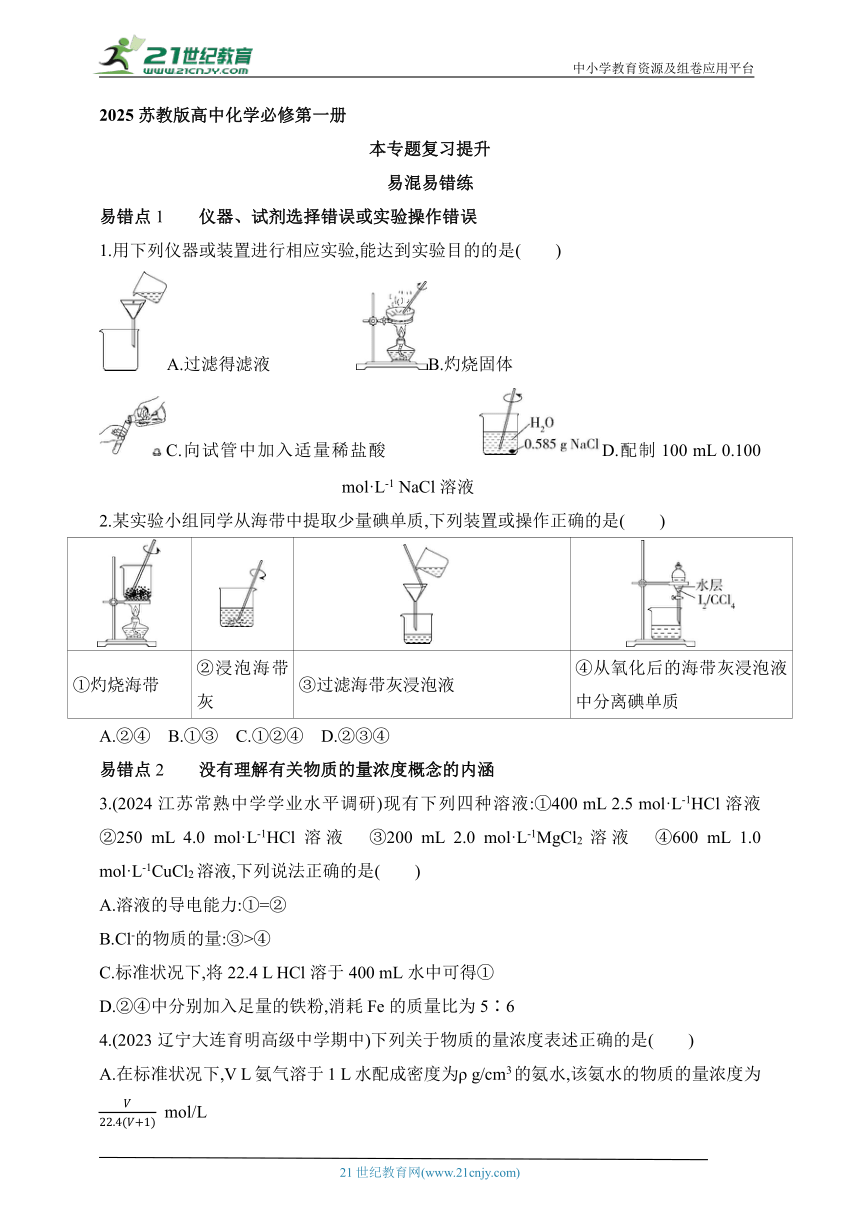
中小学教育资源及组卷应用平台 2025苏教版高中化学必修第一册 本专题复习提升 易混易错练 易错点1 仪器、试剂选择错误或实验操作错误 1.用下列仪器或装置进行相应实验,能达到实验目的的是( ) A.过滤得滤液 B.灼烧固体 C.向试管中加入适量稀盐酸 D.配制100 mL 0.100 mol·L-1 NaCl溶液 2.某实验小组同学从海带中提取少量碘单质,下列装置或操作正确的是( ) ①灼烧海带 ②浸泡海带灰 ③过滤海带灰浸泡液 ④从氧化后的海带灰浸泡液中分离碘单质 A.②④ B.①③ C.①②④ D.②③④ 易错点2 没有理解有关物质的量浓度概念的内涵 3.(2024江苏常熟中学学业水平调研)现有下列四种溶液:①400 mL 2.5 mol·L-1HCl溶液 ②250 mL 4.0 mol·L-1HCl溶液 ③200 mL 2.0 mol·L-1MgCl2溶液 ④600 mL 1.0 mol·L-1CuCl2溶液,下列说法正确的是( ) A.溶液的导电能力:①=② B.Cl-的物质的量:③>④ C.标准状况下,将22.4 L HCl溶于400 mL水中可得① D.②④中分别加入足量的铁粉,消耗Fe的质量比为5∶6 4.(2023辽宁大连育明高级中学期中)下列关于物质的量浓度表述正确的是( ) A.在标准状况下,V L氨气溶于1 L水配成密度为ρ g/cm3的氨水,该氨水的物质的量浓度为 mol/L B.0.3 mol/L硫酸钠溶液中含有钠离子和硫酸根离子总物质的量为0.9 mol C.将20 g氢氧化钠固体溶于1 L水中,所得NaOH溶液物质的量浓度为0.5 mol/L D.某浓盐酸的溶质质量分数为36.5%,密度为1.19 g/cm3,则该浓盐酸的物质的量浓度是11.9 mol/L 易错点3 溶液配制过程中误差分析错误 5.配制一定物质的量浓度的NaOH溶液时,下列操作造成所配溶液浓度偏高的是( ) A.向容量瓶中转移溶液时,容量瓶事先用蒸馏水洗涤过 B.称量时,NaOH已经潮解 C.定容时俯视容量瓶的刻度线 D.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线 6.(2023湖南常德第一中学期中)实验室中需要配制一定物质的量浓度的NaOH溶液,下列实验操作会造成所得溶液浓度偏高的是( ) A.用蒸馏水洗净容量瓶未干燥,直接配制溶液 B.溶解后未将溶液冷却,直接进行后续操作 C.溶解后洗涤烧杯和玻璃棒的洗涤液未全部转移至容量瓶中 D.定容时蒸馏水加多,液面超过刻度线,用胶头滴管迅速吸出多余的水 思想方法练 利用“微粒观”的思想认识物质的量及物质的量浓度 方法概述 高中化学中新引入物质的量及物质的量浓度的概念,相关计算所需的数学表达式比较简单,但却有着丰富的内涵,一旦不认真领会,应用起来就容易出错,避免出现错误的关键是利用“微粒观”的思想认识物质的量及物质的量浓度。就物质的量浓度而言,具体包含以下三个方面:一是明确计算表达式c(B)=n(B)/V中的溶质B所指的是什么微粒;二是要明确表达式中的体积是指溶液的体积,而不是溶剂的体积;三是物质的量浓度所使用的单位不是mol,其常用单位是 mol/L。 1.(2024江苏无锡江阴四校联考)下列说法正确的是( ) A.6.02×1022个水分子在标准状况下的体积约为2.24 L B.11.2 L CH4与18 g H2O中的H原子数一定相等 C.4.0 g NaOH溶解在100 mL水中所得溶液中c(Na+)=1.0 mol·L-1 D.25 mL 2.0 mol·L-1NaCl溶液加水稀释到100 mL,稀释后溶液中c(Cl-)=0.50 mol·L-1 2.(2023江苏连云港新海高级中学第一次月考)0.30 mol/L Na2SO4溶液和0.20 mol/L Al2(SO4)3溶液等体积混合(体积变化忽略不计),混合溶液中S的物质的量浓度为( ) A.0.50 mol/L B.0.45 mol/L C.0.25 mol/L D.0.20 mol/L 3.有Na2SO4和Fe2(SO4)3的混合溶液,其中Fe3+的物质的量浓度为0.4 mol·L-1,S的物质的量浓度为0.7 mol·L-1,则此溶液中Na+的物质的量浓度为( ) A.0.1 mol·L-1 B.0.15 mol·L-1 C.0.2 mol·L-1 D.0.25 mol·L-1 4.(2024江苏扬州期中)T ℃时,NaCl的溶 ... ...
~~ 您好,已阅读到文档的结尾了 ~~