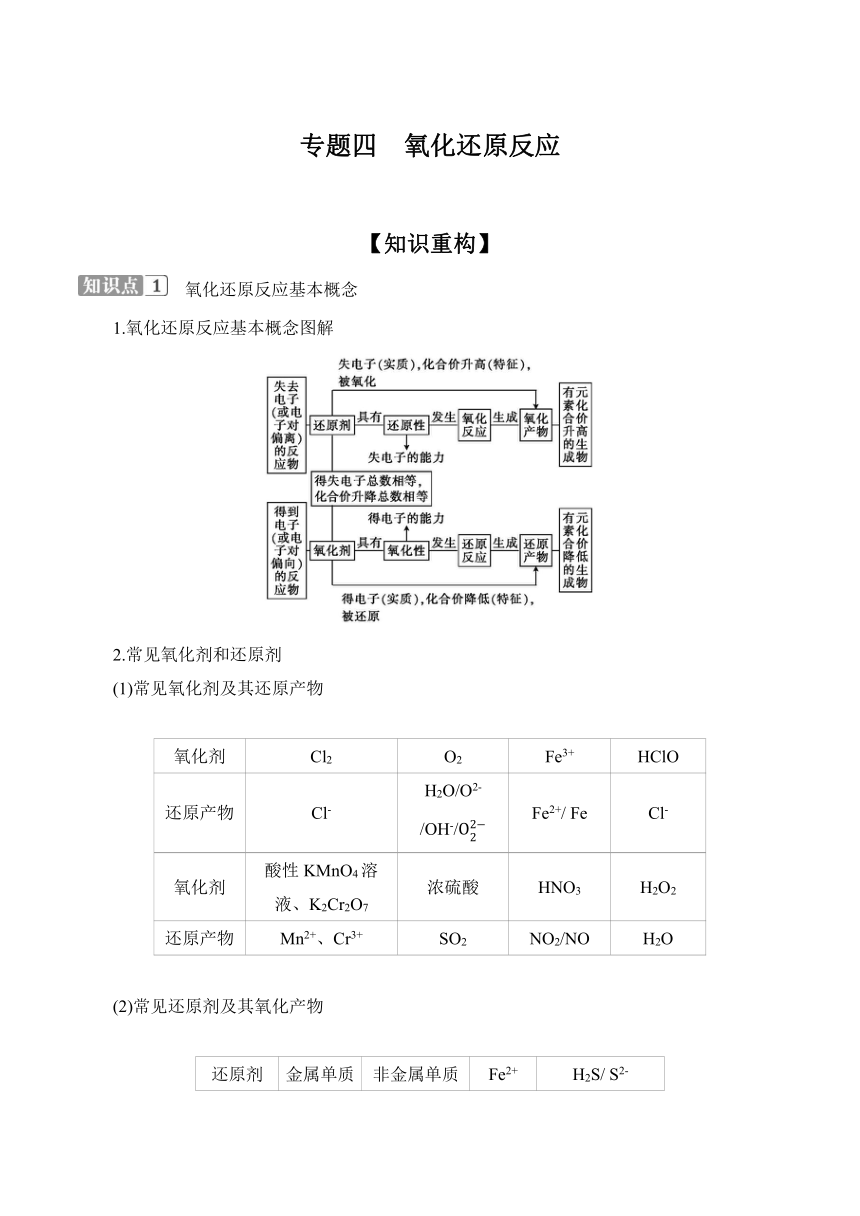
专题四 氧化还原反应 【知识重构】 氧化还原反应基本概念 1.氧化还原反应基本概念图解 2.常见氧化剂和还原剂 (1)常见氧化剂及其还原产物 氧化剂 Cl2 O2 Fe3+ HClO 还原产物 Cl- H2O/O2- /OH-/ Fe2+/ Fe Cl- 氧化剂 酸性KMnO4溶 液、K2Cr2O7 浓硫酸 HNO3 H2O2 还原产物 Mn2+、Cr3+ SO2 NO2/NO H2O (2)常见还原剂及其氧化产物 还原剂 金属单质 非金属单质 Fe2+ H2S/ S2- 氧化产物 金属离子 非金属氧化物 Fe3+ S、SO2 还原剂 HI/I- NH3 CO SO2/S 氧化产物 I2 N2、NO CO2 SO3、S 3.电子转移的表示方法 (1)双线桥法:①标变价;②画箭头;③算数目;④说变化。 (2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。 氧化还原反应的基本规律 1.氧化还原反应的基本规律 守恒律 定义 化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等。即n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值 应用 ①直接计算参与氧化还原反应物质间的数量关系 ②配平氧化还原反应方程式 强弱律 定义 氧化性强弱为氧化剂>氧化产物;还原性强弱为还原剂>还原产物 应用 ①判断某氧化还原反应中,氧化性、还原性的相对强弱 ②判断某氧化还原反应能否自发进行 优先律 定义 当存在多种还原剂(氧化剂)时,氧化剂(还原剂)通常先和还原性(氧化性)最强的还原剂(氧化剂)反应 应用 ①判断某氧化还原反应能否自发进行 ②可判断物质发生氧化还原反应的先后顺序 如向NaBr和NaI的混合溶液中通入Cl2,因I-的还原性强于Br-,则先发生反应2I-+Cl22Cl-+I2,然后发生反应2Br-+Cl22Cl-+Br2 价态律 定义 有多种价态的元素,处于最高价态时只具有氧化性(如H2SO4中的S元素),处于最低价态时只具有还原性(如H2S中的S元素),处于中间价态时既有氧化性又有还原性(如SO2中的S元素) 应用 ①判断氧化还原反应能不能发生 ②判断同种元素的不同物质间发生氧化还原反应时的化合价变化情况 转化律 定义 同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多达到同种价态 应用 如H2S+H2SO4(浓)S↓+SO2↑+2H2O(H2→,H2O4→O2);5Cl-+Cl+6H+3Cl2↑+3H2O(→,→) 2.物质氧化性、还原性强弱的应用 判断物质氧化性、还原性强弱的常用方法 (1)依据反应条件来判断 当不同的氧化剂作用于同一还原剂时,若氧化产物价态相同,可依据反应条件的难易程度来判断氧化剂氧化性的相对强弱。一般来说反应条件越苛刻,说明反应越难发生,氧化剂得电子越困难,则对应氧化剂的氧化性越弱。例如: Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 氧化性:浓硝酸>浓硫酸 (2)根据“三表”判断 ①根据元素周期表判断 ②根据金属及非金属的活动性顺序表判断 (3)依据“两池”判断 ①一般情况下,两种不同的金属构成原电池的两极时,负极是电子流出的电极,正极是电子流入的电极。则两种金属的还原性:正极<负极 ②用惰性电极电解混合溶液时,在阴极先得电子的阳离子的氧化性较强,在阳极先失去电子的阴离子的还原性较强 (4)依据“三度”(浓度、温度、酸碱度)判断 一般情况下,浓度越大,温度越高,氧化剂的氧化性(或还原剂的还原性)越强;酸碱度是影响氧化性强弱的重要因素。 例如,①KMnO4在酸性条件下具有较强的氧化性,常温下即可和浓盐酸反应制取氯气;②HNO3(浓)的氧化性强于HNO3(稀)的氧化性;③HNO3(热)的氧化性强于HNO3(冷)的氧化性 氧化还原反应方程式的书写与配平 1.氧化还原反应方程式配平的基本原则 2.氧化还原反应方程式配平的一般步骤 3.特殊的配平方法 (1)逆向配平法(主要用于同种元素之间发生的歧化反应) 例如: 因为S的化合价既有升高又有下降,S单质的化学计量数不好确定,但逆向 ... ...
~~ 您好,已阅读到文档的结尾了 ~~