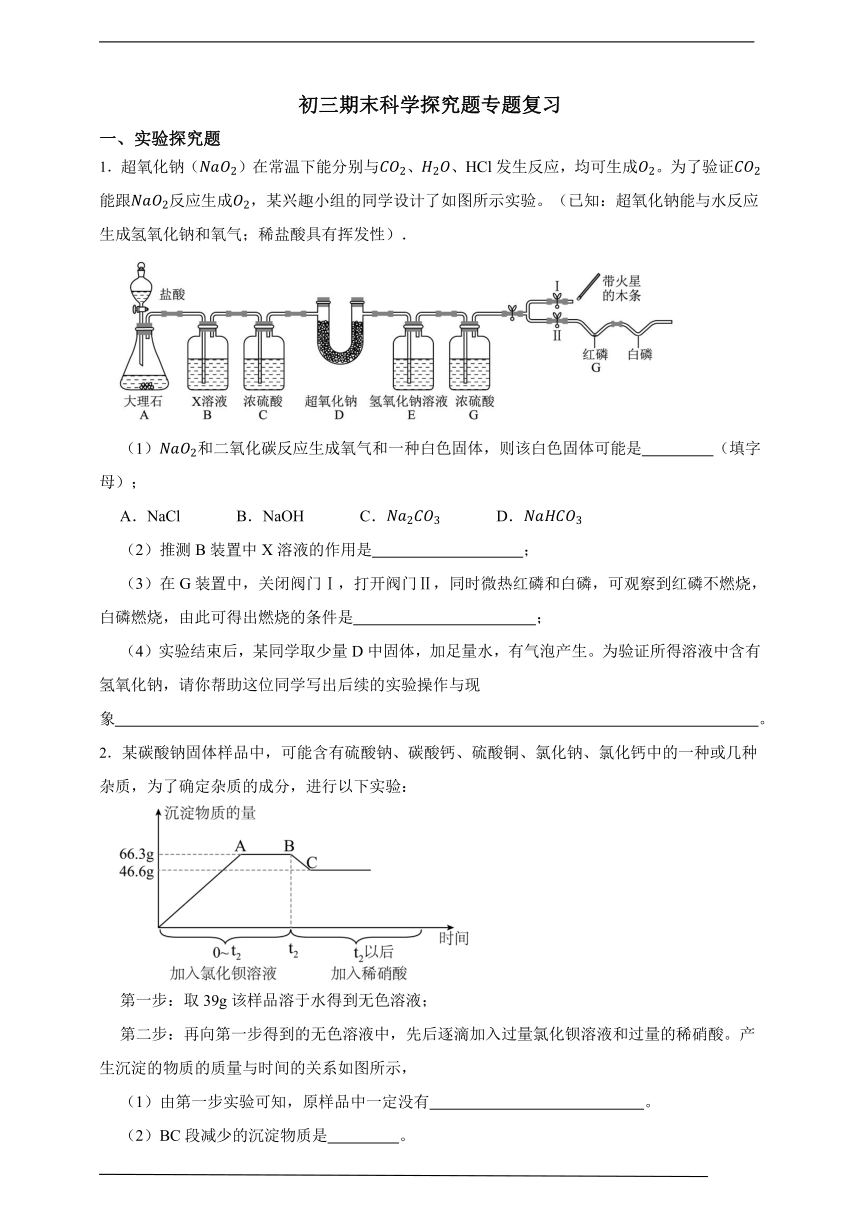
初三期末科学探究题专题复习 一、实验探究题 1.超氧化钠()在常温下能分别与、、HCl发生反应,均可生成。为了验证能跟反应生成,某兴趣小组的同学设计了如图所示实验。(已知:超氧化钠能与水反应生成氢氧化钠和氧气;稀盐酸具有挥发性). (1)和二氧化碳反应生成氧气和一种白色固体,则该白色固体可能是 (填字母); A.NaCl B.NaOH C. D. (2)推测B装置中X溶液的作用是 ; (3)在G装置中,关闭阀门Ⅰ,打开阀门Ⅱ,同时微热红磷和白磷,可观察到红磷不燃烧,白磷燃烧,由此可得出燃烧的条件是 ; (4)实验结束后,某同学取少量D中固体,加足量水,有气泡产生。为验证所得溶液中含有氢氧化钠,请你帮助这位同学写出后续的实验操作与现象 。 2.某碳酸钠固体样品中,可能含有硫酸钠、碳酸钙、硫酸铜、氯化钠、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验: 第一步:取39g该样品溶于水得到无色溶液; 第二步:再向第一步得到的无色溶液中,先后逐滴加入过量氯化钡溶液和过量的稀硝酸。产生沉淀的物质的质量与时间的关系如图所示, (1)由第一步实验可知,原样品中一定没有 。 (2)BC段减少的沉淀物质是 。 (3)由第二步数据分析,原样品中的杂质有 。 3.草木灰的主要成分为K2CO3,为验证草木灰中是否含有KOH、K2SO4,某科学学习小组对其成进行了研究。 查阅资料:CaCl2溶液、KNO3溶液、Ba(NO3)2溶液均呈中性。 【进行实验】 (1)甲同学取少量草木灰浸出液于试管中,滴入几滴紫色石蕊试液,观察到溶液变蓝,甲同学认为溶液中一定有KOH。你认为甲同学的结论 (填“正确”或“不正确”)。 (2)乙同学进行了如表所示的实验 实验操作 实验现象 实验结论 ①取少量草木灰浸出液于试管中,滴入过量的Ba(NO3)2溶液,再滴入几滴酚酞试液 出现白色沉淀,溶液不变红 不含有 ②过滤,向白色沉淀中滴加过量稀盐酸 含有K2SO4 【反思与拓展】 (3)丙同学另外的实验方案也能证明溶液中不存在KOH,你认为下列可行的是_____(填字母)。 A.先加足量CaCl2溶液,静置,取上层清液,再滴加CuCl2溶液 B.先加足量Ca(NO3)2溶液,静置。取上层清液,再滴加NaCl溶液 4.某科学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究。 【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么? 【作出猜想】 甲同学猜想:溶质有NaCl、HCl、NaOH; 乙同学猜想:溶质只有NaCl; 丙同学猜想:溶质有NaCl、HCl; (1)你的猜想:溶质有 (填化学式)。 (2)有同学认为甲同学的猜想是错误的,理由是 。 【实验设计及验证】请你将下列实验报告填写完整: 实验操作 实验现象 实验结论 取反应后的溶液于试管中,加入Na2CO3溶液 有气体产生 (3) 同学猜想正确 取反应后的溶液于试管中,加入氯化铜溶液 (4) 你的猜想正确 5.小科发现老师在做酸的化学性质实验时的一个奇怪现象:将氧化铜与稀盐酸加入到试管中,加热后得到的是绿色溶液,但老师向试管里加了一些蒸馏水后,溶液变成了蓝色。加水后为什么溶液会从绿色变成蓝色呢?对此,小科做了如下探究: 【实验猜想】①溶液的颜色可能与温度有关;②溶液的颜色可能与浓度有关 【实验过程】小科将0.5克氧化铜与20毫升7.3%的稀盐酸混合加热,将电子温度计插入到所得溶液中,然后用冷水水浴冷却,记录了如下数据和现象: 温度/℃ 70 40 20 溶液颜色 绿色 蓝绿色 蓝色 【查阅资料】①溶液中除了和还存在离子 ②呈蓝色,呈黄色 ③黄色与蓝色混合后会显示绿色 【分析讨论】 (1)本实验除了电子温度计,还需要用到的测量工具是 (2 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

