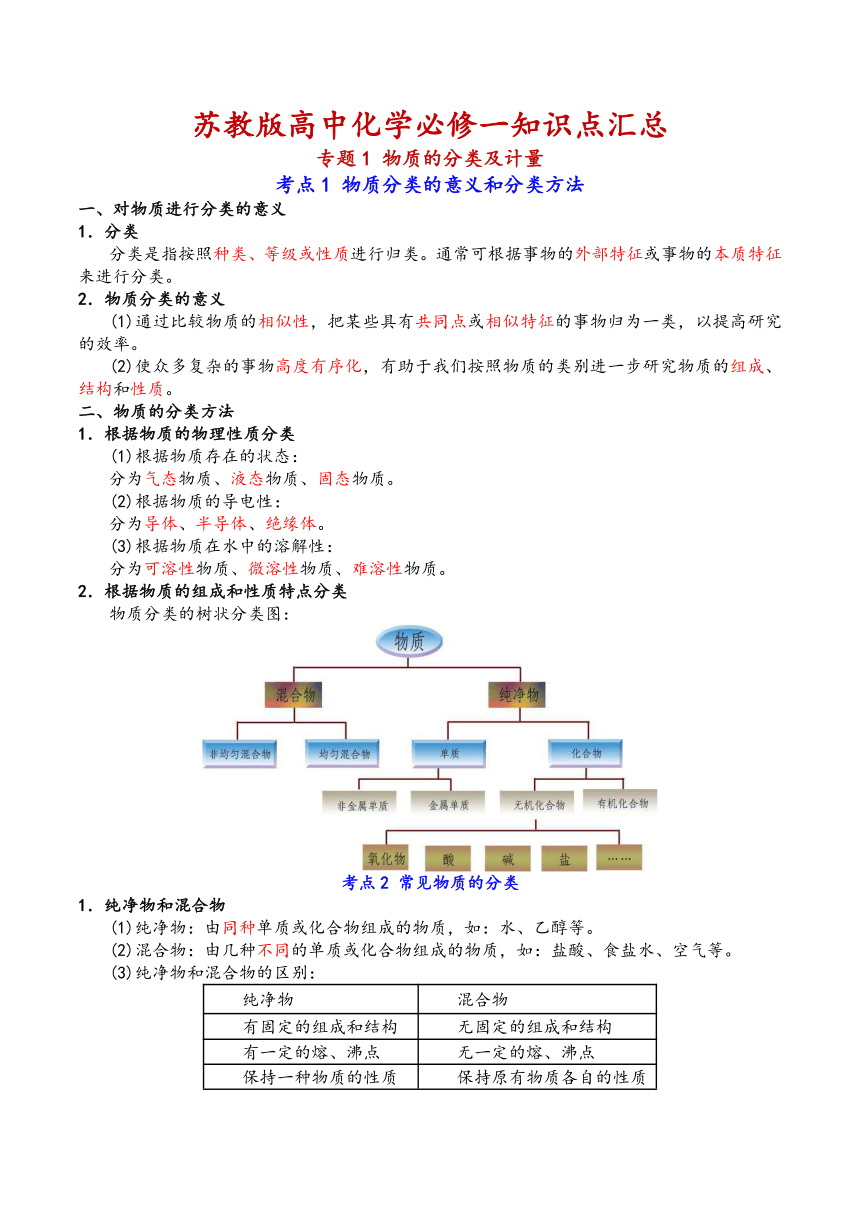
苏教版高中化学必修一知识点汇总 专题1 物质的分类及计量 考点1 物质分类的意义和分类方法 一、对物质进行分类的意义 1.分类 分类是指按照种类、等级或性质进行归类。通常可根据事物的外部特征或事物的本质特征来进行分类。 2.物质分类的意义 (1)通过比较物质的相似性,把某些具有共同点或相似特征的事物归为一类,以提高研究的效率。 (2)使众多复杂的事物高度有序化,有助于我们按照物质的类别进一步研究物质的组成、结构和性质。 二、物质的分类方法 1.根据物质的物理性质分类 (1)根据物质存在的状态: 分为气态物质、液态物质、固态物质。 (2)根据物质的导电性: 分为导体、半导体、绝缘体。 (3)根据物质在水中的溶解性: 分为可溶性物质、微溶性物质、难溶性物质。 2.根据物质的组成和性质特点分类 物质分类的树状分类图: 考点2 常见物质的分类 1.纯净物和混合物 (1)纯净物:由同种单质或化合物组成的物质,如:水、乙醇等。 (2)混合物:由几种不同的单质或化合物组成的物质,如:盐酸、食盐水、空气等。 (3)纯净物和混合物的区别: 纯净物 混合物 有固定的组成和结构 无固定的组成和结构 有一定的熔、沸点 无一定的熔、沸点 保持一种物质的性质 保持原有物质各自的性质 2.单质和化合物 (1)单质:由一种元素组成的纯净物,如:氧气、氮气、钠等。 根据组成元素不同,单质又分为金属单质(如铁、铜)、非金属单质(如氢气、氧气)、稀有气体(如氦气)。 (2)化合物:由两种或两种以上的元素组成的纯净物,如:硫酸、氢氧化钠等。 根据化合物的组成和性质,化合物又分为酸、碱、盐、氧化物等。 3.酸和碱的定义和分类 (1)酸和碱的定义 酸是指电离出来的阳离子全部是氢离子的化合物,如硫酸、HCl、硝酸等 碱是指离出来的阴离子全部是氢氧根离子的化合物,如氢氧化钾、氢氧化钙等。 (2)酸的分类 ①根据组成,将酸分为无氧酸和含氧酸 无氧酸:不含氧元素的酸,如HCl等。 含氧酸:含氧元素的酸,如H2SO4、HNO3等。 ②根据在水溶液中电离出的H+个数,分为一元酸(如HCl、HNO3)、二元酸(如H2SO4、H2CO3)和三元酸(如H3PO4)。 ③根据酸性强弱,分为强酸(如HCl、H2SO4)和弱酸(如H2CO3)。 (3)碱的分类 ①根据溶解性,NaOH、KOH和Ba(OH)2为可溶性碱;Cu(OH)2、Fe(OH)3为难溶性碱或难溶性氢氧化物;Ca(OH)2为微溶性碱。 ②根据碱性强弱,KOH、NaOH、Ca(OH)2、Ba(OH)2为强碱;NH3·H2O、Cu(OH)2等为弱碱。 3.氧化物的定义与分类 (1)定义:氧化物是指由氧元素与其他元素组成的二元化合物。 (2)氧化物的分类: ①根据组成元素,可以将氧化物分为金属氧化物和非金属氧化物。 ②根据氧化物的性质,可以将氧化物分为酸性氧化物、碱性氧化物等。其中: 酸性氧化物是指能与碱反应生成盐和水的氧化物,常见的酸性氧化物有CO2、SO2、P2O5等。 碱性氧化物是指能与酸反应生成盐和水的氧化物,常见的碱性氧化物有Na2O、MgO、Fe2O3、CuO等。 写出下列化学方程式: CaO与盐酸反应:CaO+2HCl=CaCl2+H2O。 CO2与Ca(OH)2反应:CO2+Ca(OH)2=CaCO3↓+H2O。 特别注意: ①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。 ②非金属氧化物不一定都是酸性氧化物,如CO、NO既不能与酸反应,又不能与碱反应,既不是酸性氧化物又不是碱性氧化物。 ③金属氧化物不都是碱性氧化物,如Al2O3既能与酸反应,又能与碱反应,属于两性氧化物。 4.盐的分类 (1)根据酸根中是否含有氧元素,分为含氧酸盐(如Na2CO3)、无氧酸盐(如NaCl)。 (2)根据溶解性,分为可溶性盐(如NaCl)、微溶性盐(如CaSO4)、难溶性盐(如CaCO3)。 (3)根据组成的阴离子的结构,分为正盐(如Na2CO3)、酸式盐(如NaHCO3)、碱式盐[如Cu2(OH)2CO3] 考点3 物质之间的转化 1 ... ...
~~ 您好,已阅读到文档的结尾了 ~~