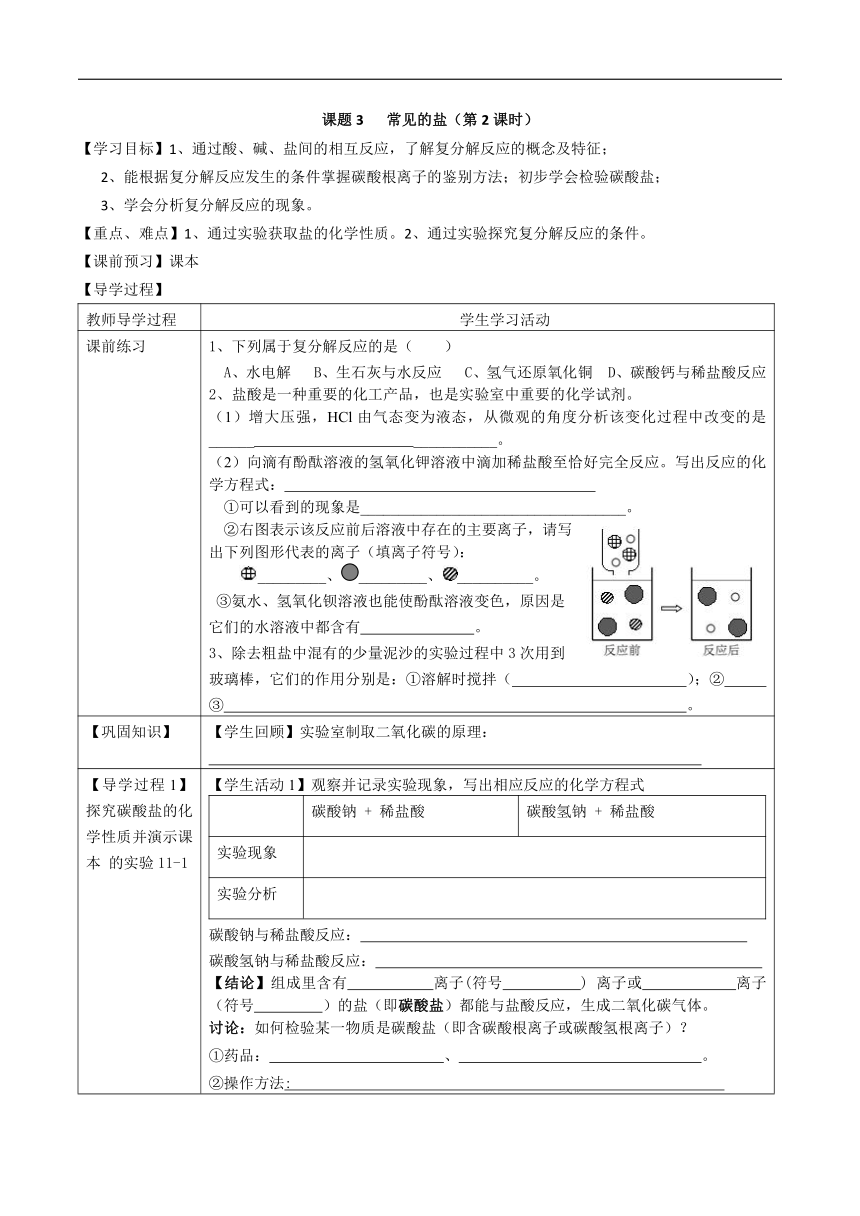
课题3 常见的盐(第2课时) 【学习目标】1、通过酸、碱、盐间的相互反应,了解复分解反应的概念及特征; 2、能根据复分解反应发生的条件掌握碳酸根离子的鉴别方法;初步学会检验碳酸盐; 3、学会分析复分解反应的现象。 【重点、难点】1、通过实验获取盐的化学性质。2、通过实验探究复分解反应的条件。 【课前预习】课本 【导学过程】 教师导学过程 学生学习活动 课前练习 1、下列属于复分解反应的是( ) A、水电解 B、生石灰与水反应 C、氢气还原氧化铜 D、碳酸钙与稀盐酸反应 2、盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。 (1)增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是_____ _____。 (2)向滴有酚酞溶液的氢氧化钾溶液中滴加稀盐酸至恰好完全反应。写出反应的化学方程式: ①可以看到的现象是_____。 ②右图表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号): _____、_____、_____。 ③氨水、氢氧化钡溶液也能使酚酞溶液变色,原因是它们的水溶液中都含有 。 3、除去粗盐中混有的少量泥沙的实验过程中3次用到玻璃棒,它们的作用分别是:①溶解时搅拌( );② ③ 。 【巩固知识】 【学生回顾】实验室制取二氧化碳的原理: 【导学过程1】探究碳酸盐的化学性质并演示课本 的实验11-1 【学生活动1】观察并记录实验现象,写出相应反应的化学方程式 碳酸钠 + 稀盐酸碳酸氢钠 + 稀盐酸实验现象实验分析 碳酸钠与稀盐酸反应: 碳酸氢钠与稀盐酸反应: 【结论】组成里含有 离子(符号 ) 离子或 离子(符号 )的盐(即碳酸盐)都能与盐酸反应,生成二氧化碳气体。 讨论:如何检验某一物质是碳酸盐(即含碳酸根离子或碳酸氢根离子)? ①药品: 、 。 ②操作方法: . ③实验现象: . 【导学过程2】 应用 【学生活动2】现有两瓶无色溶液已知分别是氯化钠和碳酸钠,请通过实验鉴别它们。 实验操作实验现象及结论 还可以选择: 【导学过程3】 探究碳酸盐的化学性质并演示课本实验11-2, 【学生活动3】观察并记录实验现象,写出相应反应的化学方程式 碳酸钠溶液 + 石灰水实验现象化学方程式 【导学过程4】 分析以上反应的特点,归纳复分解反应的概念 【学生活动4】认真观察上述反应的化学方程式,观察反应物和生成物的组成特点(注意观察,其构成微粒位置的变化)。再观察下边的化学方程式,它们是否有共同特点。 (1)Na2CO3+Ba(OH)2===BaCO3↓+2NaOH (2)2NaOH+CuSO4====Na2SO4+Cu(OH)2↓ (3)AgNO3+NaCl===AgCl↓+NaNO3 化学上把这些反应类似的反应称为复分解反应。 【学生活动5】阅读课本,了解复分解反应。 叫做复分解反应 【练习】判断下列反应是否属于复分解反应 (1) Cu(OH)2+2HCl===CuCl2+2H2O (2) Fe+H2SO4===FeSO4+H2↑ (3) CaCO3+2HCl===CaCl2+H2O+CO2 ↑ (4) Na2CO3+H2SO4===Na2SO4+H2O+CO2 ↑ (5) CO2+Ca(OH) 2===CaCO3↓+H2O (6) CO+CuO高温Cu+CO2 (7) Fe2O3 + 6HCl==2FeCl3 + 3H2O 请你试着写出前面学习过的复分解反应的化学方程式 ①酸与金属氧化物的反应: ②酸和碱的反应: ③酸和碳酸盐的反应: 【课堂练习】 1、某同学要检验贝壳的主要成分是碳酸盐,现有下列试剂:①石灰水②食醋③食盐水④纯碱溶液⑤烧碱溶液,其中必须用到的是( ) A、②⑤ B、①② C、②④ D①③ 2、下列生活中常见的主要成分,属于盐的是( ) A、醋 B、生石灰 C、纯碱 D烧碱 3、用稀碱性溶液或清水浸泡,可使残留在蔬菜叶子上的农药毒性降低。如用碱性溶液浸泡蔬菜,可在水中加入适量的 ( ) A.纯碱 B.白酒 C.白糖 D.食醋 4、能一次鉴别出Ca(OH)2、NaOH、稀HCl的试剂是 ( ) A.酚酞试液 B.Na2CO3试液 C.BaCl2试液 D.石蕊试液 5、某同学做氢氧化钙溶液与碳酸钠 ... ...
~~ 您好,已阅读到文档的结尾了 ~~