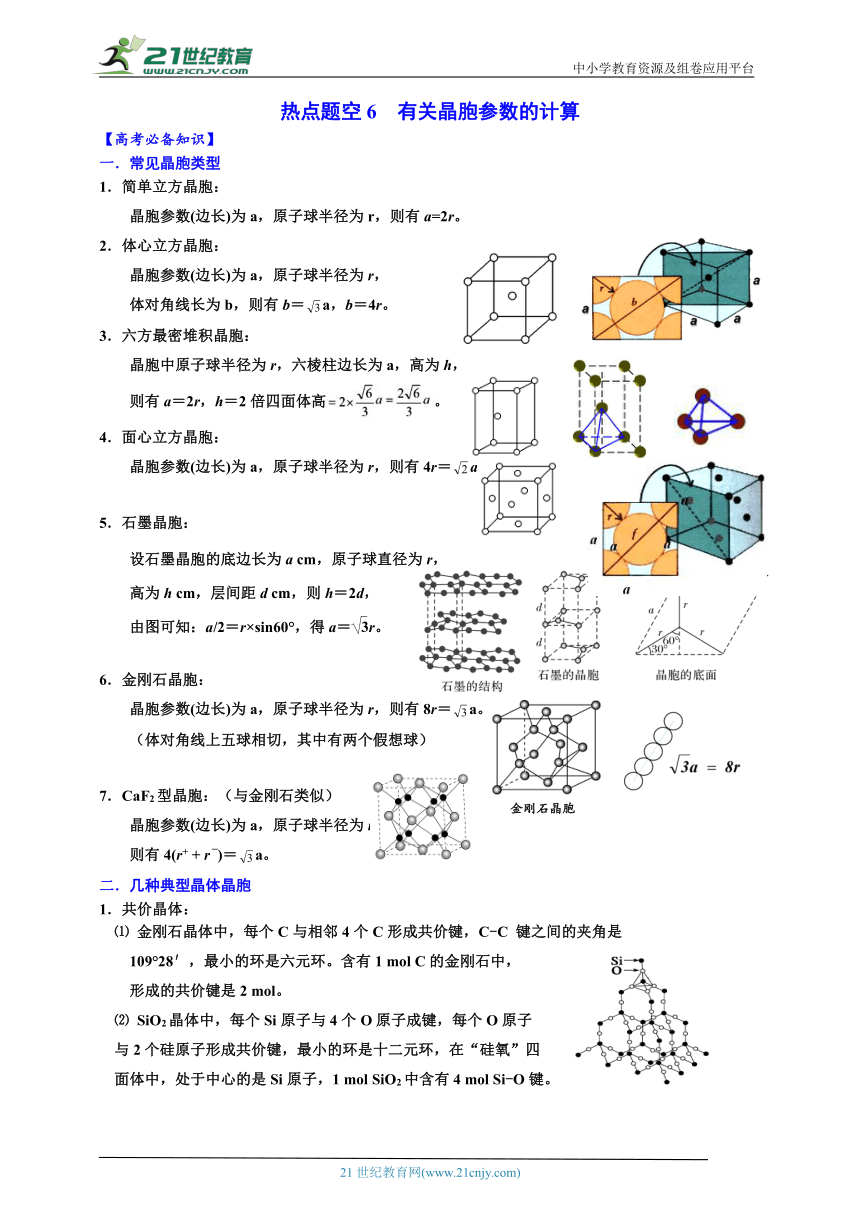
中小学教育资源及组卷应用平台 热点题空6 有关晶胞参数的计算 【高考必备知识】 一.常见晶胞类型 1.简单立方晶胞: 晶胞参数(边长)为a,原子球半径为r,则有a=2r。 2.体心立方晶胞: 晶胞参数(边长)为a,原子球半径为r, 体对角线长为b,则有b=a,b=4r。 3.六方最密堆积晶胞: 晶胞中原子球半径为r,六棱柱边长为a,高为h, 则有a=2r,h=2倍四面体高。 4.面心立方晶胞: 晶胞参数(边长)为a,原子球半径为r,则有4r=a。 5.石墨晶胞: 设石墨晶胞的底边长为a cm,原子球直径为r, 高为h cm,层间距d cm,则h=2d, 由图可知:a/2=r×sin60°,得a=r。 6.金刚石晶胞: 晶胞参数(边长)为a,原子球半径为r,则有8r=a。 (体对角线上五球相切,其中有两个假想球) 7.CaF2型晶胞:(与金刚石类似) 晶胞参数(边长)为a,原子球半径为r, 则有4(r+ + r-)=a。 二.几种典型晶体晶胞 1.共价晶体: ⑴ 金刚石晶体中,每个C与相邻4个C形成共价键,C-C 键之间的夹角是 109°28′,最小的环是六元环。含有1 mol C的金刚石中, 形成的共价键是2 mol。 ⑵ SiO2晶体中,每个Si原子与4个O原子成键,每个O原子 与2个硅原子形成共价键,最小的环是十二元环,在“硅氧”四 面体中,处于中心的是Si原子,1 mol SiO2中含有4 mol Si-O键。 2.分子晶体: ⑴ 干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有12个。 ⑵ 冰晶体中,每个水分子与相邻的4个水分子以氢键相连接,含 1 mol H2O的冰中,最多可形成2 mol“氢键”。 3.离子晶体: ⑴ NaCl型:在晶体中,每个Na+同时吸引6个Cl-, 每个Cl-同时吸引6个Na+,配位数为6。 每个晶胞含4个Na+和4个Cl-。 ⑵ CsCl型:在晶体中,每个Cl-吸引8个Cs+, 每个Cs+吸引8个Cl-,配位数为8。 4.混合型晶体—石墨: 石墨层状晶体中,层与层之间的作用是分子间作用力, 平均每个正六边形拥有的碳原子个数是2, C原子采取的杂化方式是sp2。 三.两种典型晶体堆积晶胞 1.体心立方堆积晶胞:(以CsCl为例) ⑴ Cs+、Cl-的配位数均为8。 ⑵ 白球Cs+填入黑球Cl-所形成的“立方体”空隙中。 ⑶ CsCl晶胞中含有1个“立方体”空隙, Cs+的填隙率为100%。 ⑷ 体心立方堆积的原子可以形成6个“偏八面体”空隙。 (面心6×=3个,棱心12×=3个,共6个) ⑸ 体心立方堆积原子还可以形成12个“偏四面体”空隙。 (面上24×=12个) 2.面心立方堆积晶胞: 1.以NaCl为例 ⑴ Na+、Cl-的配位数均为6。 ⑵ 黑球Cl-还可以形成“正四面体”空隙。 ⑶ NaCl晶胞中含有8个“正四面体”空隙, 空隙处无任何离子填充。 ⑷ 白球Na+填入黑球Cl-所形成的“正八面体” 空隙中。 ⑸ NaCl晶胞中含有4个“正八面体”空隙。 (体心1个,棱心12×=3个) ⑹ Na+的填隙率为100%。 四.晶体密度及微粒间距离的计算 晶体密度的计算公式推导过程 若1个晶胞中含有x个微粒,则晶胞的物质的量为:n==mol晶胞的质量为:m=n·M=g,则密度为:ρ= 右图为CsCl晶体的晶胞 假设相邻的两个Cs+的核间距为a cm,NA为阿伏加德罗常数,CsCl的摩尔质量用M g·mol-1表示,则CsCl晶体的密度为ρ=g·cm-3 五.金属晶体空间利用率的计算方法 (1)空间利用率的定义及计算步骤 ①空间利用率(η):指构成晶体的原子、离子或分子总体积在整个晶体空间中所占有的体积百分比 ② (2)金属晶体空间利用率分类简析 类型 晶体结构示意图 图示关系 简单立方堆积 原子的半径为r,立方体的棱长为2r,则V球=πr3,V晶胞=(2r)3=8r3,空间利用率=×100%=×100%=≈52% 体心立方晶胞 原子的半径为r,体对角线c为4r,面对角线b为a,由(4r)2=a2+b2得a=r。1个晶胞中有2个原子,故空间利用率=×100%=×100%=×100%=≈68% 面心立方最密堆积 原子的 ... ...
~~ 您好,已阅读到文档的结尾了 ~~