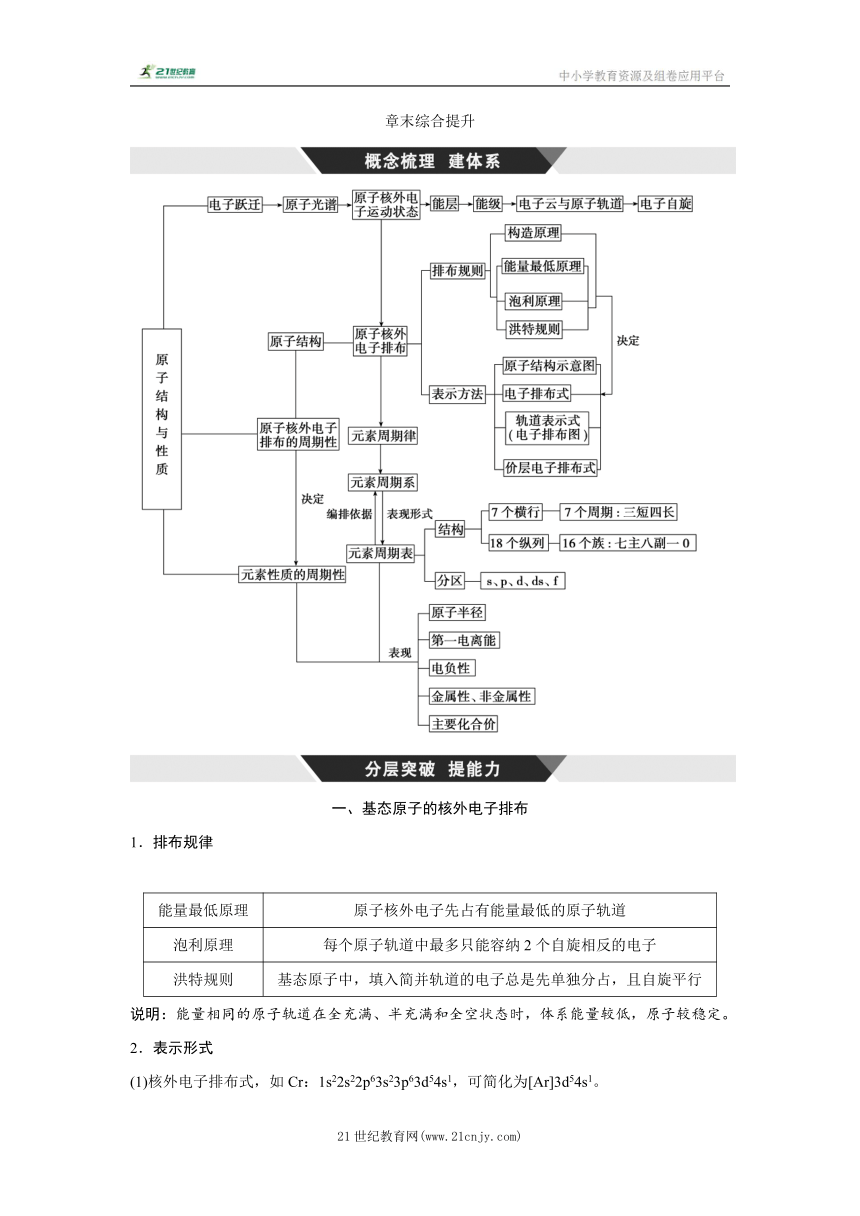
章末综合提升 一、基态原子的核外电子排布 1.排布规律 能量最低原理 原子核外电子先占有能量最低的原子轨道 泡利原理 每个原子轨道中最多只能容纳2个自旋相反的电子 洪特规则 基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行 说明:能量相同的原子轨道在全充满、半充满和全空状态时,体系能量较低,原子较稳定。 2.表示形式 (1)核外电子排布式,如Cr:1s22s22p63s23p63d54s1,可简化为[Ar]3d54s1。 (2)价层电子排布式:如Fe:3d64s2。 (3)电子排布图又称轨道表示式 如O:。 3.基态原子核外电子排布表示方法中的常见误区 (1)在写基态原子的电子排布图时,常出现以下错误:明明 (违反能量最低原理) (违反泡利原理) (违反洪特规则) (违反洪特规则) (2)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填入,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2正确,Fe:1s22s22p63s23p64s23d6错误。 (3)注意电子排布式、简化电子排布式、价层电子排布式的区别与联系。如Fe的电子排布式:1s22s22p63s23p63d64s2;简化电子排布式:[Ar]3d64s2;价层电子排布式:3d64s2。 聚氮化硫(SN)x是重要的超导材料,目前已成为全球材料行业研究的热点。 (1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。 (2)基态S原子的原子核外有_____种空间运动状态不同的电子,其能量最高电子的电子云轮廓图为_____形。 答案:(1)A (2)9 哑铃 解析:(1)氮原子为7号元素,根据能量最低原理、洪特规则、泡利原理,其最低能量状态的是A; (2)基态S原子核外电子排布为1s22s22p63s23p4,s为球形,有1种伸展方向,p是哑铃形,有x、y、z三种不同的伸展方向,故基态S原子的原子核外有1+1+3+1+3=9种空间运动状态不同的电子;原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里;其能量最高的电子为p电子,电子云轮廓图为哑铃形。 对点练1.锌在工业中有重要作用,也是人体必需的微量元素。Zn原子核外电子排布式为_____。 答案:[Ar]3d104s2(或1s22s22p63s23p63d104s2) 解析:Zn是第30页号元素,所以核外电子排布式为[Ar]3d104s2或1s22s22p63s23p63d104s2。 对点练2.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: (1)元素K的焰色试验呈紫色,其中紫色对应的辐射波长为_____nm(填字母)。 A.404.4 B.553.5 C.589.2 D.670.8 E.766.5 (2)基态K原子中,核外电子占据最高能层的符号是_____,占据该能层电子的电子云轮廓图形状为_____。 答案:(1)A (2)N 球形 解析:(1)紫色光对应的辐射波长范围是400~430 nm。 (2)基态K原子占据K、L、M、N四个能层,其中能量最高的是N能层。N能层上为4s电子,电子云轮廓图形状为球形。 对点练3.研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。 Co基态原子核外电子排布式为_____。元素Mn与O中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_____。 答案:[Ar]3d74s2(或1s22s22p63s23p63d74s2) O Mn 解析:Co是27号元素,其基态原子核外电子排布式为[Ar]3d74s2或1s22s22p63s23p63d74s2。元素Mn与O中,由于O是非金属元素而Mn是金属元素,所以O的第一电离能大于Mn的。O基态原子核外电子排布式为1s22s22p4,其核外未成对电子数是2,而Mn基态原子核外电子排布式为[Ar]3d54s2,其核外未成对电子数是5,因此Mn的基态原子核外未成对电子数比O的多。 二、元素金属性、非金属性强弱的比较方法 方法 元素金属性强弱的判断 元素非金属性强弱的判断 在元素周期表中的位置 同周期从左到右元素金属性减 ... ...
~~ 您好,已阅读到文档的结尾了 ~~