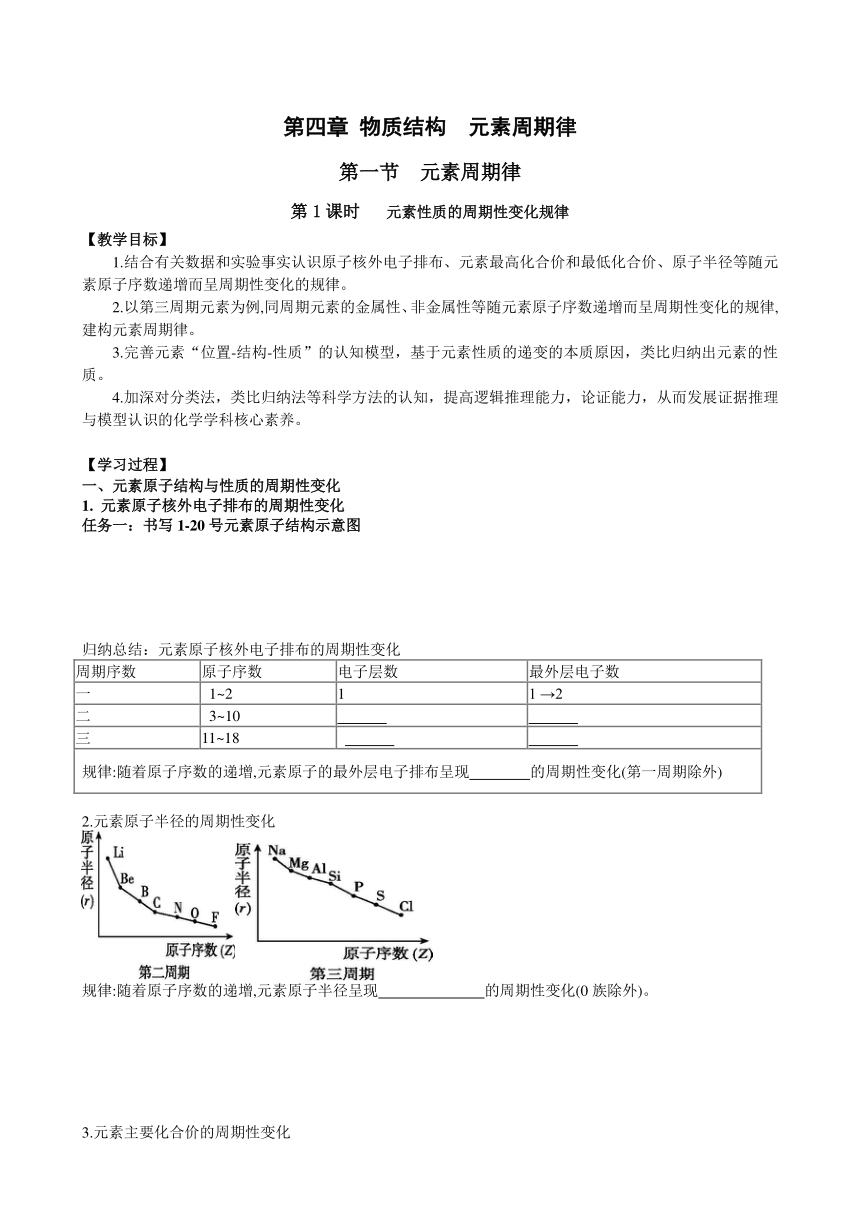
物质结构 元素周期律 第一节 元素周期律 第1课时 元素性质的周期性变化规律 【教学目标】 1.结合有关数据和实验事实认识原子核外电子排布、元素最高化合价和最低化合价、原子半径等随元素原子序数递增而呈周期性变化的规律。 2.以第三周期元素为例,同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律。 3.完善元素“位置-结构-性质”的认知模型,基于元素性质的递变的本质原因,类比归纳出元素的性质。 4.加深对分类法,类比归纳法等科学方法的认知,提高逻辑推理能力,论证能力,从而发展证据推理与模型认识的化学学科核心素养。 【学习过程】 一、元素原子结构与性质的周期性变化 1. 元素原子核外电子排布的周期性变化 任务一:书写1-20号元素原子结构示意图 归纳总结:元素原子核外电子排布的周期性变化 周期序数 原子序数 电子层数 最外层电子数 一 1~2 1 1 →2 二 3~10 三 11~18 规律:随着原子序数的递增,元素原子的最外层电子排布呈现 的周期性变化(第一周期除外) 2.元素原子半径的周期性变化 规律:随着原子序数的递增,元素原子半径呈现 的周期性变化(0族除外)。 3.元素主要化合价的周期性变化 归纳总结:元素主要化合价的周期性变化 周期数 原子序数 化合价(最高价、最低价) 一 1~2 二 3~10 最高价: 最低价: 三 11~18 最高价: 最低价: 规律:随着原子序数的递增,主族元素的最高正价呈现 (氧、氟除外)的周期性变化,最低负价呈现 的周期性变化(第一周期除外) 二、第三周期元素性质的周期性变化 1.钠、镁、铝金属性强弱比较 实验操作 实验现象 实验结论 浮: ; 熔: ; 游: ; 嘶: ; 滴加酚酞溶液变 钠与冷水反应剧烈,反应的化学方程式为 实验操作 实验现象 实验结论 加热前,镁条表面附着了少量 ,加热至沸腾后,有较多的 ,溶液变为 色 镁与冷水几乎不反应,能与热水反应,反应的化学方程式为 实验操作 实验现象 实验结论 试管①中出现 色沉淀,试管②中沉淀 ,试管③中沉淀 ; 实验1:Al(OH)3在酸或强碱溶液中都能溶解,表明它既能与酸反应,也能与强碱溶液反应,属于两性氢氧化物,反应的离子方程式分别为 、 2.Si、P、S、Cl的非金属性的递变规律 非金属元素 Si P S Cl 最高价氧化物对应的水化物(含氧酸)的酸性强弱 H2SiO3 酸 H3PO4 酸 H2SO4 酸 HClO4 酸 最高价氧化物对应的水化物(含氧酸)的酸性强弱: 非金属性由强到弱的顺序为: 总结归纳:元素性质的周期性变化 同一周期从左到右,元素金属性逐渐 ,非金属性逐渐 。 元素的性质随着原子序数的递增而呈现 。元素性质的周期性变化是元素原子的 周期性变化的必然结果。 【学习效果】 1.下列叙述不正确的是( ) A.Na、Mg、Al最高化合价依次升高 B.N、O、F非金属性依次减弱 C.P、S、Cl最高价氧化物对应水化物的酸性依次增强 D.Li、Na、K原子的电子层数依次增多 2.下列各组中化合物的性质比较,不正确的是( ) A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3 C.非金属性:F>O>S D.稳定性:HCl>PH3>H2S 3.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是 ( ) A.元素X:它的原子中M层比L层少2个电子 B.元素Y:它的二价阳离子核外电子总数与氩原子相同 C.元素Z:位于元素周期表中的第三周期第ⅢA 族 D.元素W:它的焰色试验呈黄色 4.如图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( ) A.a的最高价氧 ... ...
~~ 您好,已阅读到文档的结尾了 ~~