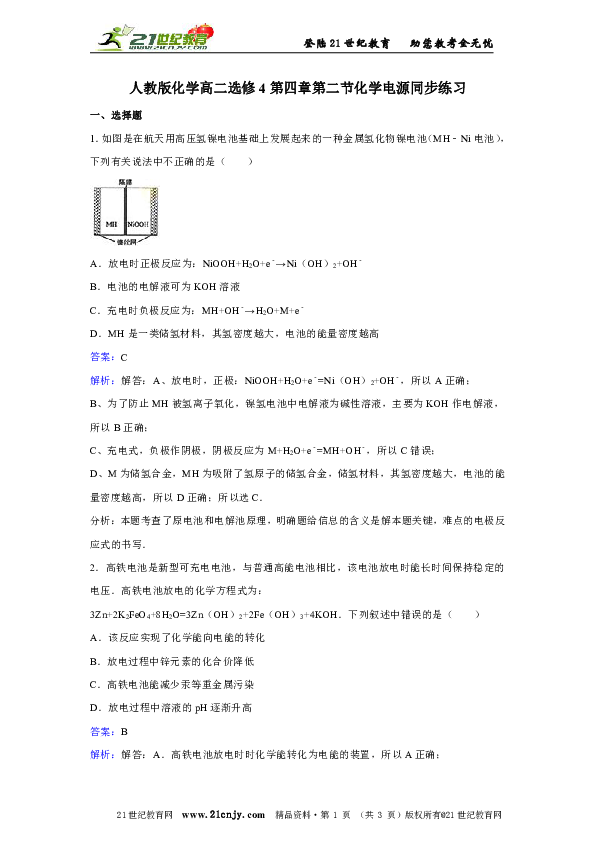
登陆21世纪教育 助您教考全无忧 人教版化学高二选修4第四章第二节化学电源同步练习 一、选择题 1.如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH﹣Ni电池),下列有关说法中不正确的是( ) A.放电时正极反应为:NiOOH+H2O+e﹣→Ni(OH)2+OH﹣ B.电池的电解液可为KOH溶液 C.充电时负极反应为:MH+OH﹣→H2O+M+e﹣ D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高 答案:C 解析:解答:A、放电时,正极:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣,所以A正确; B、为了防止MH被氢离子氧化,镍氢电池中电解液为碱性溶液,主要为KOH作电解液,所以B正确; C、充电式,负极作阴极,阴极反应为M+H2O+e﹣=MH+OH﹣,所以C错误; D、M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高,所以D正确;所以选C. 分析:本题考查了原电池和电解池原理,明确题给信息的含义是解本题关键,难点的电极反应式的书写. 2.高铁电池是新型可充电电池,与普通高能电池相比,该电池放电时能长时间保持稳定的电压.高铁电池放电的化学方程式为: 3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述中错误的是( ) A.该反应实现了化学能向电能的转化 B.放电过程中锌元素的化合价降低 C.高铁电池能减少汞等重金属污染 D.放电过程中溶液的pH逐渐升高 答案:B 解析:解答:A.高铁电池放电时时化学能转化为电能的装置,所以A正确; B.放电时,Zn被氧化,化合价升高,所以B错误; C.高铁电池不含汞等重金属,可减少污染,所以C正确; D.放电时,生成KOH,溶液pH升高,所以D正确.所以选B. 分析:本题考查原电池的工作原理,本题注意根据总电池反应式判断,把握原电池的工作原理. 3.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( ) A.分子组成为Cm(H2O)n的物质一定是糖类 B.微生物所在电极区放电时发生还原反应 C.放电过程中,H+从正极区移向负极区 D.正极反应式为:MnO2+4H++2e﹣═Mn2++2H2O 答案:D 解析:解答:A.分子组成为Cm(H2O)n的物质不一定为糖类,与甲醛、乳酸、乙酸乙酯等物质,所以A错误; B.形成原电池时,微生物所在电极区发生氧化反应,Cm(H2O)n被氧化生成水和二氧化碳,所以B错误; C.原电池工作时,阳离子向正极移动,阴离子向负极移动,所以C错误; D.MnO2被还原生成Mn2+,为原电池的正极,电极方程式为MnO2+4H++2e﹣═Mn2++2H2O,所以D正确.所以选D. 分析:本题考查新型电池,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极. 4.氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液.下列说法正取的是( ) A.负极反应为:2H2+4OH﹣﹣4e﹣═4H2O B.负极反应为:O2+2H2O+4e﹣═4OH﹣ C.电池工作时溶液中的阴离子移向正极 D.电池工作时正极区pH下降,负极区pH升高 答案:A 解析:解答:A.电池工作时,负极发生氧化反应,负极发生的反应为:2H2﹣4e﹣+4OH﹣═4H2O,所以A正确; B.电池工作时,正极发生还原反应,电极反应式为O2+H2O+4e﹣═4OH﹣,所以B错误; C.电池工作时溶液中的阴离子移向负极,阳离子移向正极,所以C错误; D.由电极反应式可知,电池工作时正极区pH升高,负极区pH下降,所以D错误;所以选A. 分析:本题考查原电池知识,本题注意把握电解反应式的书写为解答该题的关键. 5.一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( ) A.a极为电池的正极 B.电池工作时电流由a极沿导线经灯泡再到b极 ... ...
~~ 您好,已阅读到文档的结尾了 ~~