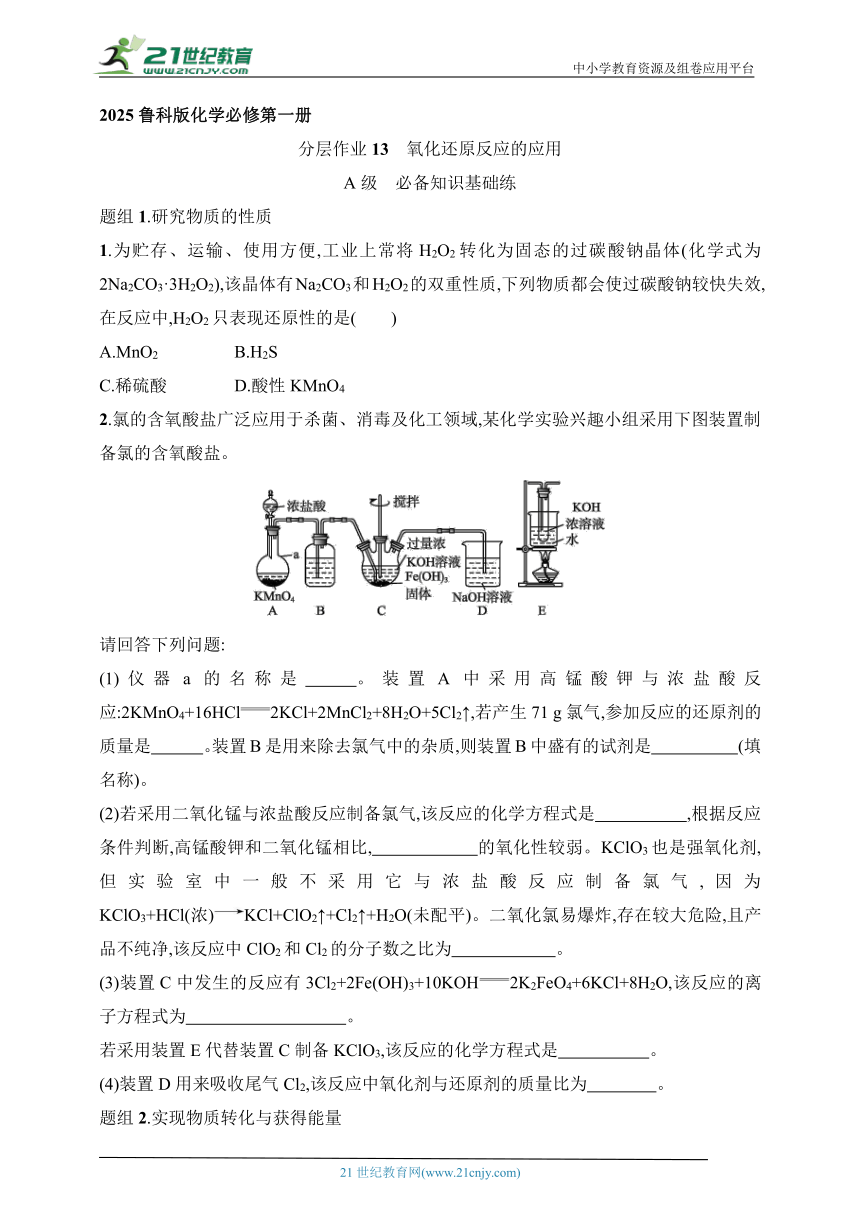
中小学教育资源及组卷应用平台 2025鲁科版化学必修第一册 分层作业13 氧化还原反应的应用 A级 必备知识基础练 题组1.研究物质的性质 1.为贮存、运输、使用方便,工业上常将H2O2转化为固态的过碳酸钠晶体(化学式为2Na2CO3·3H2O2),该晶体有Na2CO3和H2O2的双重性质,下列物质都会使过碳酸钠较快失效,在反应中,H2O2只表现还原性的是( ) A.MnO2 B.H2S C.稀硫酸 D.酸性KMnO4 2.氯的含氧酸盐广泛应用于杀菌、消毒及化工领域,某化学实验兴趣小组采用下图装置制备氯的含氧酸盐。 请回答下列问题: (1)仪器a的名称是 。装置A中采用高锰酸钾与浓盐酸反应:2KMnO4+16HCl2KCl+2MnCl2+8H2O+5Cl2↑,若产生71 g氯气,参加反应的还原剂的质量是 。装置B是用来除去氯气中的杂质,则装置B中盛有的试剂是 (填名称)。 (2)若采用二氧化锰与浓盐酸反应制备氯气,该反应的化学方程式是 ,根据反应条件判断,高锰酸钾和二氧化锰相比, 的氧化性较弱。KClO3也是强氧化剂,但实验室中一般不采用它与浓盐酸反应制备氯气,因为KClO3+HCl(浓)KCl+ClO2↑+Cl2↑+H2O(未配平)。二氧化氯易爆炸,存在较大危险,且产品不纯净,该反应中ClO2和Cl2的分子数之比为 。 (3)装置C中发生的反应有3Cl2+2Fe(OH)3+10KOH2K2FeO4+6KCl+8H2O,该反应的离子方程式为 。 若采用装置E代替装置C制备KClO3,该反应的化学方程式是 。 (4)装置D用来吸收尾气Cl2,该反应中氧化剂与还原剂的质量比为 。 题组2.实现物质转化与获得能量 3.下列冶炼金属的方法错误的是( ) A.加热分解HgO制金属Hg B.高温下用CO还原赤铁矿炼铁 C.电解氯化铝制金属铝 D.Fe和CuSO4溶液湿法炼铜 4.乙醇可以通过粮食、秸秆发酵生成,也可以通过工业合成;乙醇作为燃料可以制作燃料电池获得电能。下列选项中属于乙醇作为燃料的优点的是( ) ①燃烧时,燃料发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种可再生能源 ④燃烧时放出大量热量 A.①②③ B.①②④ C.①③④ D.②③④ 5.实验室也可以用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O。现用如图所示装置制取纯净的无水CuCl2(部分仪器和夹持装置已略去)。下列说法正确的是( ) A.装置C中试剂是饱和食盐水,目的是除去HCl气体 B.实验过程中,硬质玻璃管中产生大量棕黄色的烟 C.实验时,应该先加热装置D,再打开A中分液漏斗的活塞 D.将装置A中的KMnO4直接换为MnO2,也可完成该实验 6.青铜是人类历史上一项伟大的发明,它是红铜和锡、铅的合金,也是金属冶铸史上最早的合金。铜及其合金在日常生活中应用广泛。回答下列问题: (1)西汉刘安在《淮南万毕术》中介绍了我国在西汉时期发明的湿法冶金技术,即“曾青得铁则化为铜”,其含义是铜的可溶性化合物的水溶液与铁反应生成铜。例如:将适量的铁粉加入硫酸铜溶液中,发生反应CuSO4+FeCu+FeSO4。 ①该反应发生时,溶液的颜色变化为 。 ②用双线桥法标出该反应中电子转移的方向和数目。 ③每生成6.4 g Cu,消耗的CuSO4的质量为 g。 (2)工业冶炼铜的原理主要是: ⅰ.2Cu2S+3O22Cu2O+2SO2 ⅱ.2Cu2O+Cu2S6Cu+SO2↑ ①Cu2S中Cu元素的化合价为 价。 ②反应ⅰ中,生成的SO2属于 (填“氧化”“还原”或“氧化和还原”)产物,将其通入足量的NaOH溶液中,发生反应的化学方程式为2NaOH+SO2Na2SO3+H2O,该反应的离子方程式为 。 ③将Cu2O固体加入稀硝酸中,发生反应 Cu2O+ HNO3(稀) Cu(NO3)2+ NO↑+ H2O,配平该化学方程式。 B级 关键能力提升练 以下选择题有1~2个选项符合题意。 7.(2024河南商丘名校模拟联考)将分液漏斗中的 ... ...
~~ 您好,已阅读到文档的结尾了 ~~