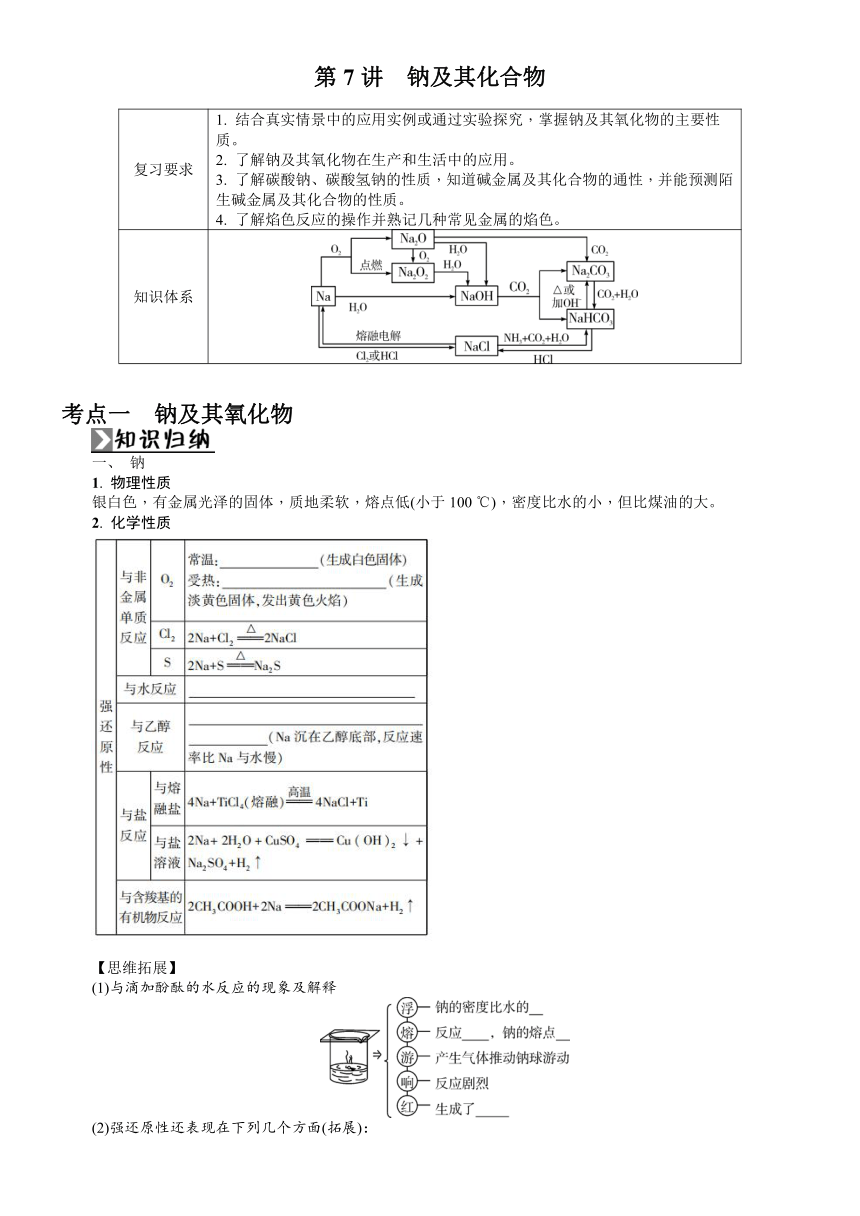
第7讲 钠及其化合物 复习要求 1. 结合真实情景中的应用实例或通过实验探究,掌握钠及其氧化物的主要性质。2. 了解钠及其氧化物在生产和生活中的应用。3. 了解碳酸钠、碳酸氢钠的性质,知道碱金属及其化合物的通性,并能预测陌生碱金属及其化合物的性质。4. 了解焰色反应的操作并熟记几种常见金属的焰色。 知识体系 考点一 钠及其氧化物 一、 钠 1. 物理性质 银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。 2. 化学性质 【思维拓展】 (1)与滴加酚酞的水反应的现象及解释 (2)强还原性还表现在下列几个方面(拓展): ①与NH3反应:2Na+2NH3===2NaNH2+H2。 ②与H2反应:2Na+H2_____。 3. 钠的制取、保存与用途 制取 化学方程式为_____ 保存 通常保存在_____或_____中 用途 (1)钠钾合金(液态)用于原子反应堆,作导热剂(2)作强还原剂,从钛、锆、铌、钽等熔融氯化物中冶炼某些金属[如:4Na+TiCl4(熔融) 4NaCl+Ti](3)作电光源,制作高压钠灯 二、 钠的氧化物 1. 氧化钠和过氧化钠的比较 续表 色、态 白色固体 淡黄色固体 阴、阳离子个数比 1∶2 1∶2 是否为碱性氧化物 是 不是 与水反应的化学方程式 Na2O+H2O===2NaOH _____ 与CO2反应的化学方程式 Na2O+CO2===Na2CO3 _____ 与盐酸反应的化学方程式 Na2O+2HCl===2NaCl+H2O 2Na2O2+4HCl===4NaCl+2H2O+O2↑ 2. Na2O2的强氧化性与还原性 从元素化合价角度分析Na2O2的性质 2Na22 (1)Na2O2表现强氧化性 (2)Na2O2表现还原性 当遇KMnO4等强氧化剂时,Na2O2被氧化,其氧化产物为O2。 (3)Na2O2既表现氧化性又表现还原性 遇CO2、H2O、H+则发生自身的氧化还原反应。 【易错辨析】 1. 金属钠着火时,可用泡沫灭火器或干燥的沙土灭火。( ) 2. 钠表面自然形成的氧化层能够保护内层金属不被空气氧化。( ) 3. 钠与乙醇反应时钠浮于液面上四处游动。( ) 4. 金属钠投入水中:2Na+2H+===2Na++H2↑。( ) 5. 1 mol Na2O2固体中含离子总数为4NA。( ) 1. (2025·无锡高三质检)下列有关钠及其化合物的性质与用途具有对应关系的是( ) A. Na具有强还原性,可用于冶炼金属钛 B. NaOH具有强碱性,可用作干燥剂 C. Na2O2具有强氧化性,可用作呼吸面具供氧剂 D. Na2S具有还原性,可用于除去工业废水中的Hg2+ 2. 为探究Na2O2与H2O的反应,进行了如下实验。有关说法不正确的是( ) A. 实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑ B. 实验ⅲ中MnO2做H2O2分解反应的催化剂 C. 综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成 D. 综合实验表明,实验ⅱ酚酞褪色的原因是溶液碱性变弱 考点二 碳酸钠与碳酸氢钠 一、 碳酸钠与碳酸氢钠的比较 名称 碳酸钠 碳酸氢钠 俗名 _____ _____ 续表 主要性质 色、态 白色粉末 细小的白色晶体 水溶性 易溶于水(20 ℃,S=21.5 g) 可溶于水(20 ℃,S=9.6 g) 热稳定性 稳定,但结晶碳酸钠(Na2CO3·10H2O)易_____ 受热易_____ 续表 主要性质 与H+反应 相同条件下CO+2H+===CO2↑+H2O(较快) HCO+H+===CO2↑+H2O(更快) 与NaOH溶液反应 不反应 HCO+OH-===CO+H2O 与Ca(OH)2溶液反应 _____ Ca(OH)2少量:_____;Ca(OH)2过量:_____ 与CaCl2溶液反应 Ca2++CO===CaCO3↓ Ca2++2HCOCaCO3↓+CO2↑+H2O 与Al2(SO4)3溶液反应 2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑ Al3++3HCO===Al(OH)3↓+3CO2↑ 与水作用 同浓度时水解,碱性较____ 水解,碱性较____ 与CO2反应 CO+CO2+H2O===HCO 不反应 相互转化 主要用途 用于制玻璃、制肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业中 灭火器、治疗胃酸过多、发酵粉的主要成分之一 , 二、 碳酸钠 ... ...
~~ 您好,已阅读到文档的结尾了 ~~