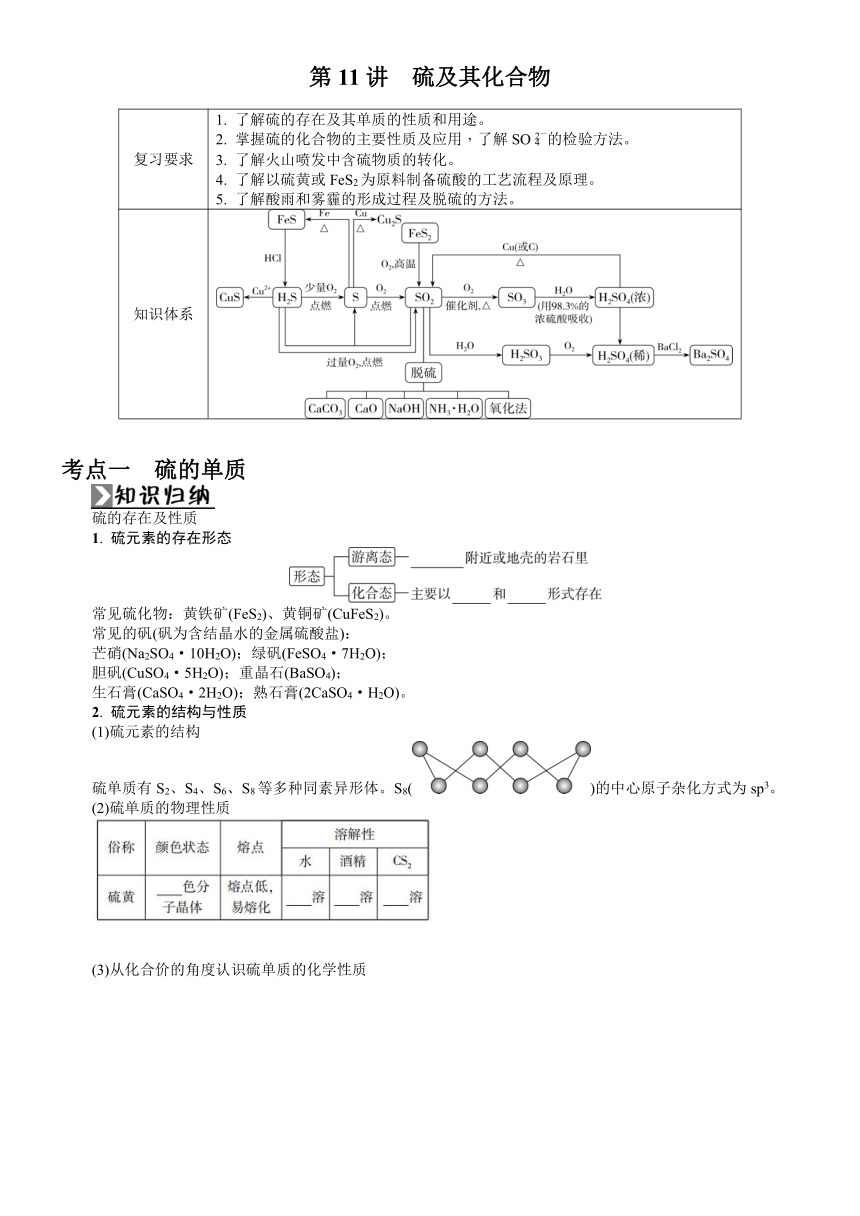
第11讲 硫及其化合物 复习要求 1. 了解硫的存在及其单质的性质和用途。2. 掌握硫的化合物的主要性质及应用,了解SO的检验方法。3. 了解火山喷发中含硫物质的转化。4. 了解以硫黄或FeS2为原料制备硫酸的工艺流程及原理。5. 了解酸雨和雾霾的形成过程及脱硫的方法。 知识体系 考点一 硫的单质 硫的存在及性质 1. 硫元素的存在形态 常见硫化物:黄铁矿(FeS2)、黄铜矿(CuFeS2)。 常见的矾(矾为含结晶水的金属硫酸盐): 芒硝(Na2SO4·10H2O);绿矾(FeSO4·7H2O); 胆矾(CuSO4·5H2O);重晶石(BaSO4); 生石膏(CaSO4·2H2O);熟石膏(2CaSO4·H2O)。 2. 硫元素的结构与性质 (1)硫元素的结构 硫单质有S2、S4、S6、S8等多种同素异形体。S8()的中心原子杂化方式为sp3。 (2)硫单质的物理性质 (3)从化合价的角度认识硫单质的化学性质 3. 硫的用途 硫可制农药、硫酸、黑火药、染料、橡胶制品以及可以用来消除汞蒸气等。 【易错辨析】 1. 很多家庭都备有水银温度计,若不慎打破,应立即用硫黄粉末覆盖。( ) 2. 试管内壁上沾有单质硫,可用CS2或热的强碱溶液洗涤。( ) 3. 硫与铁粉和铜粉分别反应,都可生成二价金属硫化物。( ) 4. 等质量的S6和S8分子分别与足量的KOH溶液反应,消耗KOH的物质的量相同。( ) 5. 硫在空气中燃烧的产物是SO2,在纯氧中燃烧的产物是SO3。( ) 中医用药讲究十八反和十八畏,其中有“硫黄原是火中精,朴硝一见便相争”,硫黄即硫单质。下列说法中正确的是( ) A. 硫只以化合态存在于自然界中 B. 过量的硫与铁反应生成Fe2S3,表现了硫单质的氧化性 C. 试管内壁上的硫黄可用酒精清洗 D. 硫在氧气中燃烧生成二氧化硫,葡萄酒中添加适量的二氧化硫可以起到杀菌防腐的作用。 考点二 二氧化硫和三氧化硫 一、 二氧化硫的结构 SO2中,硫原子杂化类型为_____,SO2的空间结构为_____形,是极性分子,属于分子晶体。 二、 二氧化硫的性质 1. 二氧化硫的物理性质 色、味、态 密度 溶解性 无色、有刺激性气味的有毒气体 比空气的大 易溶于水,通常状况下,1体积的水溶解约40体积的SO2 2. 二氧化硫的化学性质 【思维拓展】 含硫物质的相互转化 (1)SO2、H2SO3、NaHSO3、Na2SO3的转化关系(类比CO2、H2CO3、NaHCO3、Na2CO3的转化关系): ①的离子方程式:_____ ②的离子方程式:_____ ③的化学方程式:_____ ④的化学方程式:_____ (2)SO2、H2SO3、NH4HSO3、(NH4)2SO3的转化关系: ⑦的化学方程式:_____ ⑧的化学方程式:_____ ⑨的化学方程式:_____ 三、 二氧化硫的实验室制法 原理 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O 装置 收集方法 向上排空气法 尾气处理 氢氧化钠溶液吸收 二氧化硫的另一种实验室制法:铜与浓H2SO4混合加热,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。 四、 三氧化硫 1. 三氧化硫的结构 SO3中硫原子的杂化类型为_____,SO3的空间结构为_____形,是非极性分子,属于分子晶体。 2. 三氧化硫的性质 (1)物理性质 熔点:16.8 ℃,沸点:44.8 ℃,常温常压下为液态,标准状况下为固态(无色、针状晶体)。 (2)化学性质 三氧化硫具有酸性氧化物的通性,主要反应如下: 【思维拓展】 将常见的酸性氧化物的气体通入可溶性钙盐 (或钡盐)溶液中的现象归纳 气体 溶液 现象 说明 CO2 CaCl2或BaCl2溶液 无明显现象 不反应(忽略CO2与水的反应) SO2 CaCl2或BaCl2溶液 无明显现象 不反应(忽略SO2与水的反应) 续表 SO2 Ba(NO3)2溶液 产生白色沉淀 生成BaSO43Ba2++3SO2+2NO+2H2O===3BaSO4↓+2NO↑+4H+ SO3、SO2 BaCl2溶液 产生白色沉淀 只生成BaSO4(没有生成BaSO3) 五、 硫的氧化物对环境的影响 1. 硫的氧化物的来源、危害及治理 2. 硫酸型酸雨的形成过程 【易错辨析】 1. SO2与过量氨水反应生 ... ...
~~ 您好,已阅读到文档的结尾了 ~~