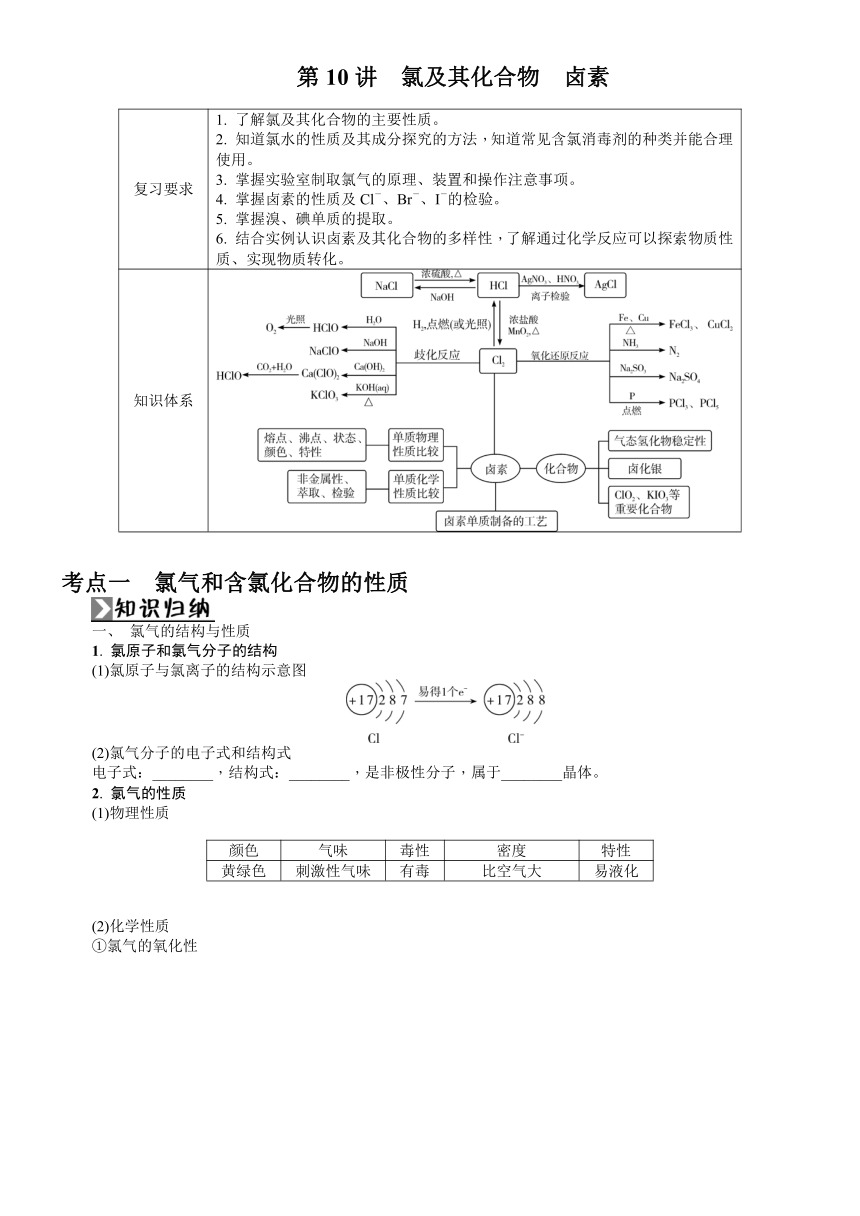
第10讲 氯及其化合物 卤素 复习要求 1. 了解氯及其化合物的主要性质。2. 知道氯水的性质及其成分探究的方法,知道常见含氯消毒剂的种类并能合理使用。3. 掌握实验室制取氯气的原理、装置和操作注意事项。4. 掌握卤素的性质及Cl-、Br-、I-的检验。5. 掌握溴、碘单质的提取。6. 结合实例认识卤素及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化。 知识体系 考点一 氯气和含氯化合物的性质 一、 氯气的结构与性质 1. 氯原子和氯气分子的结构 (1)氯原子与氯离子的结构示意图 (2)氯气分子的电子式和结构式 电子式:_____,结构式:_____,是非极性分子,属于_____晶体。 2. 氯气的性质 (1)物理性质 颜色 气味 毒性 密度 特性 黄绿色 刺激性气味 有毒 比空气大 易液化 (2)化学性质 ①氯气的氧化性 ②氯气的歧化反应 二、 氯水及其成分的检验 氯水中主要含氯微粒为Cl2,只有少量Cl2与水反应生成HCl和HClO。在25 ℃时,1体积的水可溶解约2体积的氯气,氯气的水溶液称为氯水,溶于水中的部分氯气与水反应。 (1)从平衡的角度理解氯水的成分和性质 (2)氯水成分的检验 【注意】 ①氯气能使潮湿的有色布条褪色,却不能使干燥的有色布条褪色,说明干燥的氯气无漂白性,氯气与水反应生成的HClO有漂白性。 ②不能用pH试纸测定氯水的pH,因为氯水会使pH试纸先变红后褪色。 三、 次氯酸和次氯酸盐的性质 1. 次氯酸 2. 漂白液 3. 漂白粉 四、 氯气的制法 1. 实验室制法 【思维拓展】 实验室制取氯气的其他方法 HCl-1 (浓)Cl02 (1)KMnO4与浓盐酸反应制氯气 离子方程式:2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。 KMnO4与浓盐酸反应制氯气的实验装置(不加热)如图所示。 (2)K2Cr2O7与浓盐酸反应制氯气 离子方程式:Cr2O+14H++6Cl-===2Cr3++3Cl2↑+7H2O。 (3)KClO3与浓盐酸反应制氯气 化学方程式:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。 (4)Ca(ClO)2与浓盐酸反应制氯气 化学方程式:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。 2. 粗盐的精制 海水―→粗盐(含Fe3+、Mg2+、Ca2+、SO)溶解、过滤过滤蒸发结晶 其中,①依次加NaOH、BaCl2、Na2CO3或依次加BaCl2、NaOH、Na2CO3或依次加BaCl2、Na2CO3、NaOH;②过滤后,在溶液中滴入盐酸,调节溶液的pH=7。 【易错辨析】 1. 闻氯气气味时,应用手在瓶口轻轻扇动,使极少量气体飘进鼻孔。( ) 2. 可以用pH试纸测定氯水的pH。( ) 3. “84”消毒液的消毒原理和H2O2的相同,都是利用强氧化性。( ) 4. 向FeCl2溶液中滴加氯水,观察溶液颜色变化,探究氯水中含有HClO。( ) 5. Cl2中含有HCl杂质,可将气体通过饱和食盐水除去。( ) 类型1 物质的性质与用途 1. (2024·镇江一模)氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO与ClO,在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是( ) A. NaClO3具有氧化性,可用于制取ClO2 B. Cl2有还原性,可用于从海水中提取溴 C. HClO不稳定,可用于棉、麻漂白 D. FeCl3溶液呈酸性,可用于蚀刻印刷电路板 类型2 氯水成分的探究 2. 在探究新制饱和氯水成分的实验中,根据现象得出的结论不正确的是( ) A. 氯水的颜色呈浅绿色,说明氯水中含有Cl2 B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D. 向FeCl2溶液中滴加氯水,溶液 ... ...
~~ 您好,已阅读到文档的结尾了 ~~