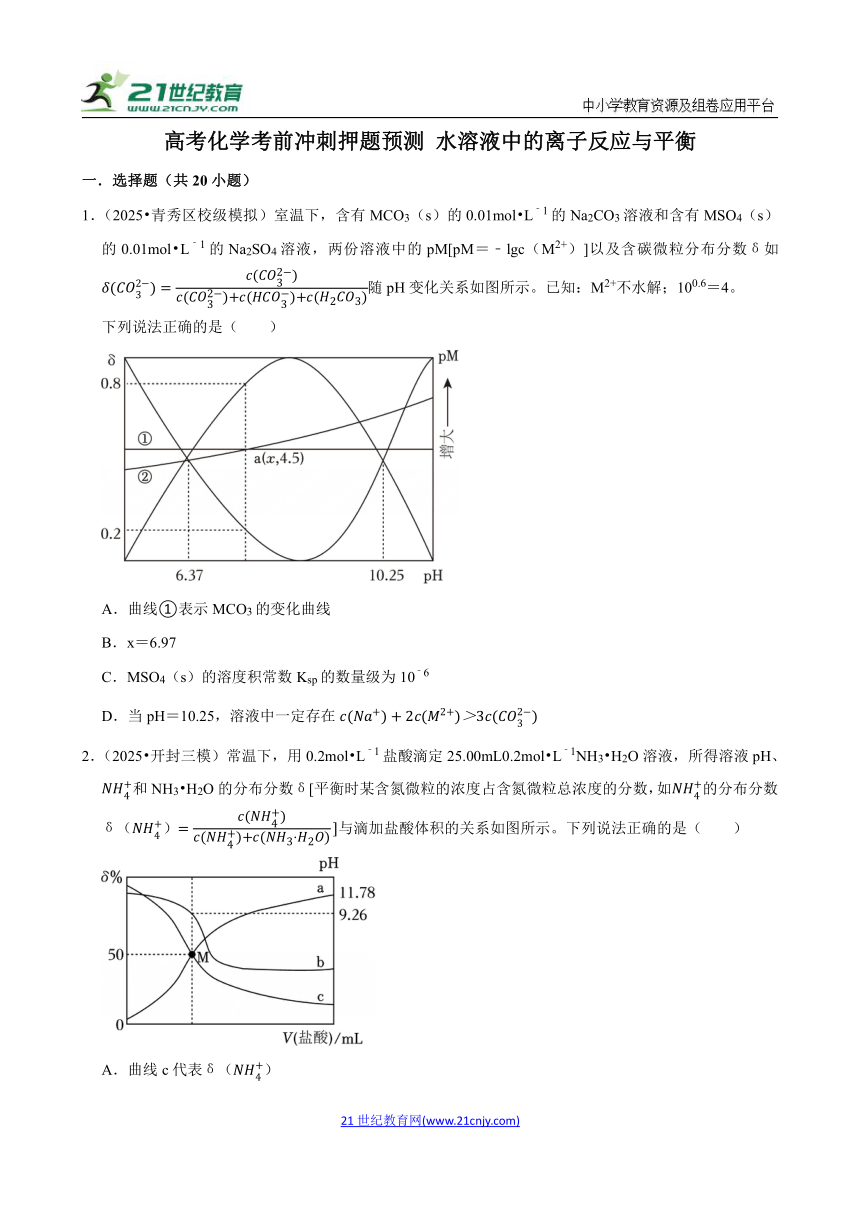
高考化学考前冲刺押题预测 水溶液中的离子反应与平衡 一.选择题(共20小题) 1.(2025 青秀区校级模拟)室温下,含有MCO3(s)的0.01mol L﹣1的Na2CO3溶液和含有MSO4(s)的0.01mol L﹣1的Na2SO4溶液,两份溶液中的pM[pM=﹣lgc(M2+)]以及含碳微粒分布分数δ如随pH变化关系如图所示。已知:M2+不水解;100.6=4。 下列说法正确的是( ) A.曲线①表示MCO3的变化曲线 B.x=6.97 C.MSO4(s)的溶度积常数Ksp的数量级为10﹣6 D.当pH=10.25,溶液中一定存在 2.(2025 开封三模)常温下,用0.2mol L﹣1盐酸滴定25.00mL0.2mol L﹣1NH3 H2O溶液,所得溶液pH、和NH3 H2O的分布分数δ[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如的分布分数δ()与滴加盐酸体积的关系如图所示。下列说法正确的是( ) A.曲线c代表δ() B.M点加入盐酸体积为12.5mL C.NH3 H2O的电离常数的数量级为10﹣5 D.应选酚酞作为指示剂,滴定终点溶液由红色变为无色 3.(2025 辽宁模拟)常温常压下,先将NH3缓慢通入饱和食盐水中至饱和,再向所得溶液中缓慢通入CO2(忽略气体的挥发),测得溶液中水电离的随通入气体(NH3或CO2)体积变化的曲线如图所示[已知:(NH4)2CO3显碱性]。下列叙述正确的是( ) A.由a点到b点的过程中,溶液中减小 B.c点pH=7 C.d点时水电离程度最大,溶液溶质为(NH4)2CO3 D.b至e点的总反应为NH3+CO2+H2O=NH4HCO3 4.(2025 辽阳二模)一种高效除去废水中的的电化学装置如图所示。已知常温下,Ksp(FePO4)=1.3×10﹣22,Ksp[Fe(OH)3]=2.8×10﹣39。下列说法正确的是( ) A.若以铅蓄电池为电源,则a极应与Pb电极相连 B.阳极发生的电极反应为4Fe2++O2+4H++44FePO4↓+2H2O C.开始电解前应先调节pH约为2,若pH>4,该电解原理除去的效率更高 D.电路中有0.3mol电子通过时,理论上最多生成的FePO4的质量为22.65g 5.(2025 昆明一模)现有10.00mLHCl和H2C2O4的混合溶液,二者的浓度分别为0.2000mol L﹣1和0.1000mol L﹣1。实验室用0.1000mol L﹣1NaOH溶液滴定,滴定过程中含碳微粒的分布分数δ及溶液pH随NaOH溶液体积的变化关系如图所示。下列说法错误的是( ) [已知:。 A.曲线①表示δ(H2C2O4) B.a点时溶液中存在c(H2C2O4) C.pH≈2时,溶液中10c(H2C2O4) D.滴定曲线表明无法单独滴定上述混合酸中的HCl 6.(2025 天津二模)已知25℃时,有如下物质相关信息,下列判断正确的是( ) CH3COOH H2CO3 CaCO3 Ka=1.8×10﹣5 Ka1=4.5×10﹣7,Ka2=4.7×10﹣11 Ksp=3.4×10﹣9 A.向Na2CO3溶液中滴入酚酞,溶液变红的主要原因是:2H2O H2CO3+2OH﹣ B.25℃时,CH3COOH与CH3COONa混合溶液的1.8时,pH=5 C.25℃时,浓度均为1.0×10﹣4mol/L的Na2CO3溶液与CaCl2溶液等体积混合,有CaCO3沉淀生成 D.25℃时,0.1mol/LNaHCO3溶液中c()>c(H2CO3) 7.(2025 黄冈三模)常温下向二元酸H3RO2的溶液中滴加烧碱溶液,各种含R微粒的分布系数δ(某含R微粒的浓度占所有含R微粒总浓度的百分数)随pH的变化如图。下列说法错误的是( ) A.H3RO2为弱酸 B.H3RO3的一级电离常数为10﹣3.8 C.NaH2RO2的水溶液呈酸性 D.pH=8.1时 8.(2025 河西区二模)亚磷酸(H3PO3)为二元弱酸,分子结构是,25℃时,某亚磷酸溶液中含磷微粒的浓度之和为0.1mol/L,溶液中所有含磷微粒的pc与pOH的关系如图所示。已知:pc=﹣lgc,pOH=﹣lgc(OH﹣),下列说法正确的是( ) A.亚磷酸溶液中: B.水的电离程度:x<y<z C.溶液pH=4时: D.反应的平衡常数K=1.0×10﹣5.3 9.(2025春 南昌县校级期中)硫化氢(H2S)是一种有臭鸡蛋气味的剧毒气体,在水溶液中电离方程式为:;HS﹣ S2﹣+H ... ...
~~ 您好,已阅读到文档的结尾了 ~~