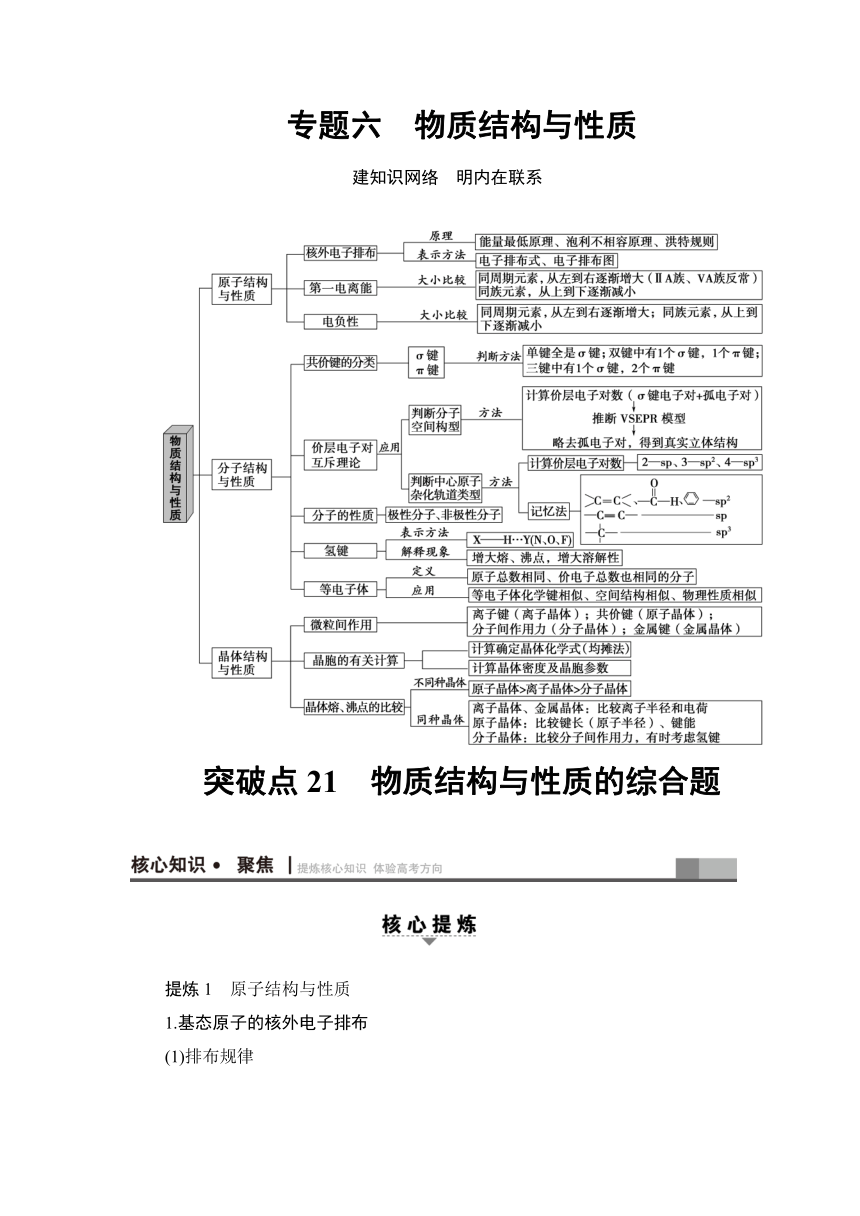
专题六 物质结构与性质 建知识网络 明内在联系 突破点21 物质结构与性质的综合题 提炼1 原子结构与性质 1.基态原子的核外电子排布 (1)排布规律 能量最低原理 原子核外电子总是先占有能量最低的原子轨道 泡利不相容原理 每个原子轨道上最多只能容纳2个自旋方向相反的电子 洪特规则 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同 特别提醒 能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。如24Cr的基态原子的核外电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。 (2)四种表示方法 表示方法 举例 电子排布式 Cr:1s22s22p63s23p63d54s1 简化表示式 Cu:[Ar]3d104s1 价电子排布式 Fe:3d64s2 电子排布图(或轨道表示式) 2.元素第一电离能和电负性的变化规律 同周期(从左到右) 同主族(自上而下) 第一电离能 增大趋势(注意ⅡA、ⅤA的特殊性) 依次减小 电负性 依次增大 依次减小 特别提醒 同周期元素,ⅡA族(np0)和ⅤA族(ns2np3),因p轨道处于全空或半满状态,比较稳定,所以其第一电离能大于同周期右侧相邻的ⅢA族、ⅥA族元素,如第一电离能Mg>Al,P>S。 提炼2 分子结构与性质 1.共价键的分类 分类依据 类型 形成共价键的原子轨道重叠方式 σ键 “头碰头”重叠 π键 “肩并肩”重叠 形成共价键的电子对是否偏移 极性键 共用电子对发生偏移 非极性键 共用电子对不发生偏移 原子间共用电子对的数目 单键 原子间有一对共用电子对 双键 原子间有两对共用电子对 三键 原子间有三对共用电子对 【特别提醒】 ①单键为σ键;双键或三键,其中一个为σ键,其余为π键。 ②配位键为一种特殊的共价键,共用电子由成键原子单方面提供。 ③s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ键。 2.价层电子对互斥理论的两大应用 应用Ⅰ:判断分子空间构型 (1)判断思路:价层电子对数目→价层电子对空间构型分子的空间构型 (2)各种电子对的计算方法及其关系 价层电子对数=中心原子形成σ键电子对数+中心原子上的孤电子对数 ①中心原子形成σ键电子对数=与中心原子结合的原子数目 ②中心原子上的孤电子对数=(a-xb) 其中a为中心原子价电子数(若为离子,则加上阴离子所带的负电荷数或减去阳离子所带的正电荷数)。 x为与中心原子结合的原子数。 b为与中心原子结合的原子最多能接受的电子数。 (3)常见的分子空间构型与价层电子对空间构型的关系 价层电子对数 σ键电子对数 孤电子对数 价层电子对空间构型 分子空间构型 实例 2 2 0 直线形 直线形 BeCl2 3 3 0 平面三角形 平面三角形 BF3 2 1 V形 SnBr2 4 4 0 正四面体形 正四面体形 CH4 3 1 三角锥形 NH3 2 2 V形 H2O 应用Ⅱ:判断杂化轨道类型 (1)判断思路:价层电子对数目→杂化轨道数目→杂化类型 (2)相互关系 价层电子对数 杂化轨道数 杂化类型 2 2 sp 3 3 sp2 4 4 sp3 3.分子构型与分子极性的关系 提炼3 晶体结构与性质 1.晶体类型的判断 (1)据各类晶体的概念判断,即根据构成晶体的粒子和粒子间的作用力类别进行判断。如由分子通过分子间作用力(范德华力、氢键)形成的晶体属于分子晶体;由原子通过共价键形成的晶体属于原子晶体;由阴、阳离子通过离子键形成的晶体属于离子晶体;由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。 (2)据各类晶体的特征性质判断,如低熔、沸点的晶体属于分子晶体;熔、沸点较高,且在水溶液中或熔融状态下能导电的晶体属于离子晶体;熔、沸点很高,不导电,不溶于一般溶剂的晶体属于原子晶体;能导电、传热、具有延展性的晶体属于金属晶体。 2.立方体(长方体)晶胞组成的计算方法 3.晶胞各物理量的计 ... ...
~~ 您好,已阅读到文档的结尾了 ~~