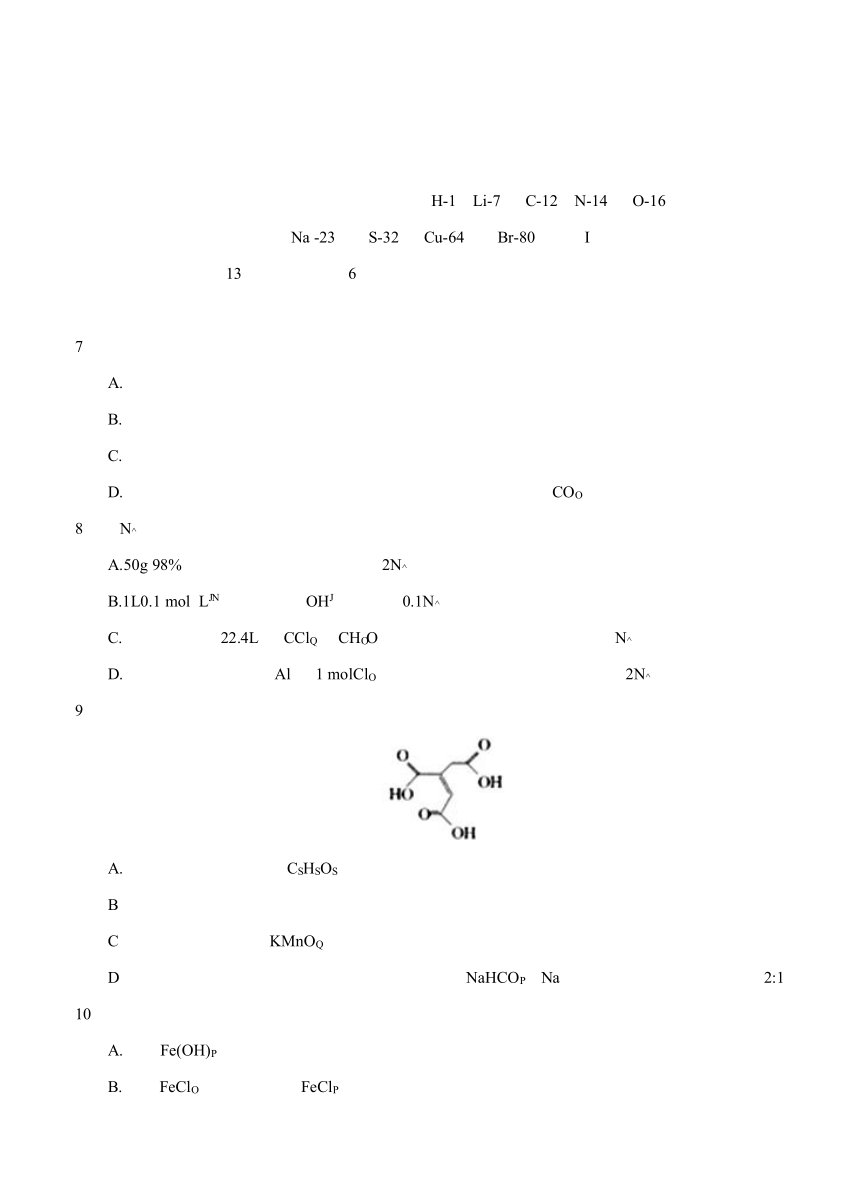
湖南省长沙市2017届高三下学期5月模拟考试 理科综合化学 可能用到的相对原子质量: H-1 Li-7 C-12 N-14 O-16 Na -23 S-32 Cu-64 Br-80 第 I卷 一、选择题:本题共13小题,每小题6分,在毎小题列出的四个选项中,只有一个是符合题目要求的。 7、化学与生产、生活、社会发展息息相关。下列说法正确的是 A.食品包装时放入盛有还原铁粉的透气小袋可防止食品氧化变质 B.聚乙烯、聚氯乙烯均可作为包装材料,且不会造成环境污染 C.华为自主研发的“麒麟”芯片与光导纤维是同种材料 D.小苏打能作焙制蛋糕的膨松剂是由于小苏打能与碱反应生成CO2 8、设NA表示阿伏伽德罗常数的值。下列有关叙述正确的是 A.50g 98%的硫酸中含有氧原子数目为2NA B.1L0.1 mol L-1氨水中含有OH-的数目为0.1NA C.标准状况下,22.4L由CCl4和CH2O组成的混合物中含碳原子数目为NA D.常温常压下,足量的Al与1 molCl2共热充分反应后,转移电子数目为2NA 9、顺式乌头酸是一种重要的食用增味剂,其结构简式如图所示。下列有关说法错误的是 A.该有机物的分子式为:C6H6O6 B.该有机物分子中含有两种官能团 C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同 D.相同条件下,等量的顺式乌头酸分别与足量的NaHCO3、Na反应,产生气体的体积比为2:1 10、下列实验操作能达到实验目的的是 A.制备Fe(OH)3胶体:向饱和氯化铁溶液中滴加氨水 B.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 C.检验食盐中是否含有KIO3:取少量食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 D.证明在相同温度下Ksp[Mg(OH) 2]>Ksp[Fe(OH)3]:向10mL0.2 mol L-1NaOH溶液中滴入2滴0.1 mol L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol L-1FeCl3溶液,观察现象 11、一种微生物燃料电池的工作原理如图所示。下列有关该电池的说法错误的是 A.a电极是该电池的负极,发生氧化反应 B.b电极反应式为2NO3-+10e-+12H+==N2↑+6H2O C.电池工作时,H+由左室通过质子交换膜进入右室 D.转化室中发生反应后溶液的pH增大(忽略体积变化) 12、有关X、Y、Z、W四种短周期元素性质的数据如下表: 元素代号 X Y Z W 原子半径/pm 66 70 143 160 主要化合价 -2 +5、+3、-3 +3 +2 下列有关叙述中错误的是 A.X和Y能形成多种共价化合物B.最简单氢化物的沸点:X>Y C.工业上常用电解Z的氯化物水溶液的方法制备Z单质 D. Z和W的氧化物均能溶于Y的最高价氧化物对应的水化物溶液中 13、一定温度下,在3个体积均为1.0 L 的恒容密闭容器中发生反应X(g) +Y(g)2Z(g) ΔH<0并达到平衡,部分数据如下表所示。下列有关说法正确的是 容器 温度/℃ 物质的起始浓度/mol L-1 物质的平衡浓度/mol L-1 c(X) c(Y) c(Z) c(Z) I 758 0.2 0.1 0 0.1 Ⅱ 758 0.1 0.05 0 Ⅲ 858 0.2 0.1 0 A.从开始至平衡时,容器I中Z的反应速率为0.044 mol L-1 s-1 B.平衡时,容器Ⅱ中Z的浓度为0.05 mol L-1 C.平衡时,容器Ⅲ中Z的浓度大于0.1 mol L-1 D.若起始时向容器I中充入0.02 mol X、0.01 mol Y和0.02 mol Z,则反应向正反应方向进行 26、(14分)氮化铝(AlN)是一种新型 无机非金属材料、工业上由氧化铝与焦炭在氮气中高温制得的氮化铝中常含有Al4C3等杂质。已知Al4C3与水反应生成CH4,CH4能被CuO氧化。某实验小组在实验室测定氮化铝中Al4C3的含量,实验装置如下: 回答下列问题: (1)氮化铝与NAOH溶液反应放出氨气,该反应的化学方程式为_____。 (2)实验装置依次连接的合理顺序为A、_____(装置可重复使用) (3)连接装置后应进行的操作是_____,其方法是_____。 (4)装置B中发生反应的化学方程式为_____。 (5)实验中需称量样品的质量和_____。 27、(14分)磷石膏是在 磷酸生产中用硫酸处理磷矿时产生 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

