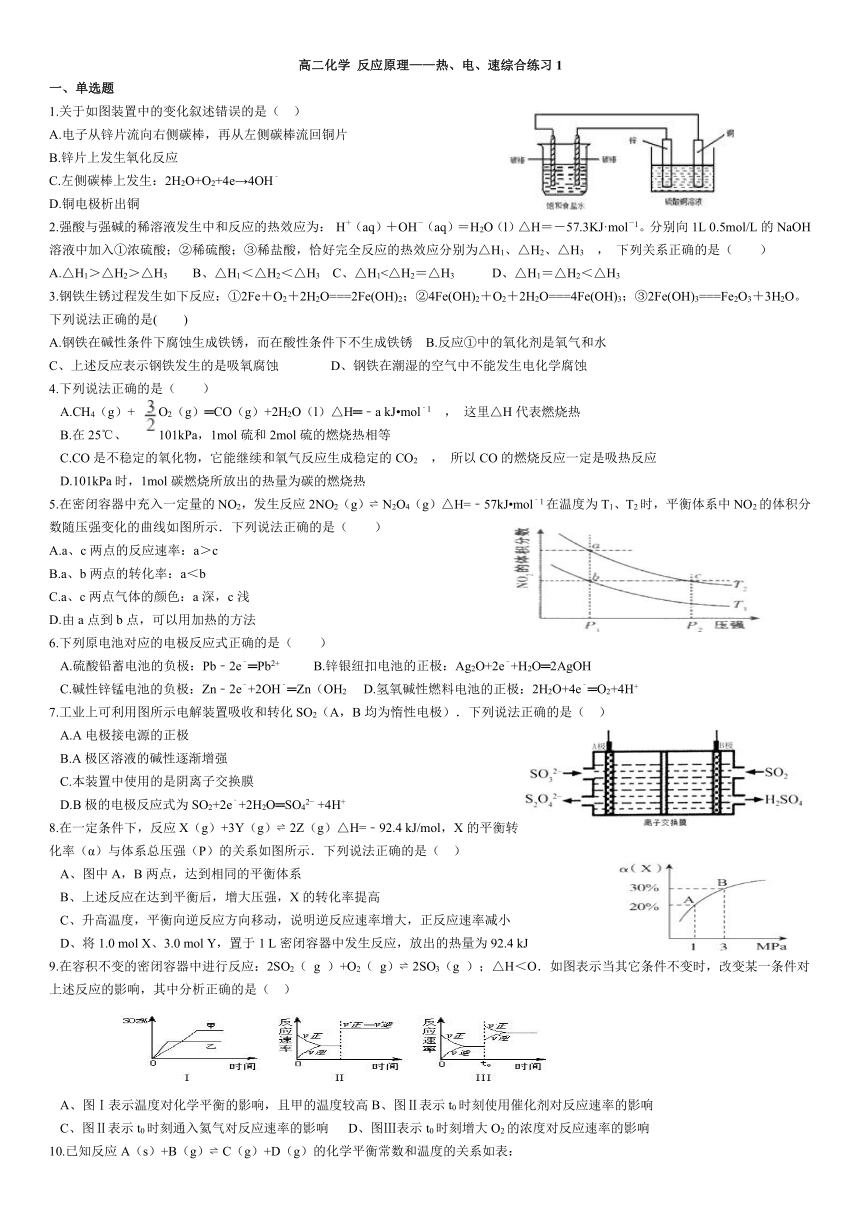
高二化学 反应原理———热、电、速综合练习1 一、单选题 1.关于如图装置中的变化叙述错误的是( ) A.电子从锌片流向右侧碳棒,再从左侧碳棒流回铜片 B.锌片上发生氧化反应 C.左侧碳棒上发生:2H2O+O2+4e→4OH﹣ D.铜电极析出铜 2.强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( ) A.△H1>△H2>△H3 B、△H1<△H2<△H3 C、△H1<△H2=△H3 D、△H1=△H2<△H3 3.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O===2Fe(OH)2;②4Fe(OH)2+O2+2H2O===4Fe(OH)3;③2Fe(OH)3===Fe2O3+3H2O。下列说法正确的是( ) A.钢铁在碱性条件下腐蚀生成铁锈,而在酸性条件下不生成铁锈 B.反应①中的氧化剂是氧气和水 C、上述反应表示钢铁发生的是吸氧腐蚀 D、钢铁在潮湿的空气中不能发生电化学腐蚀 4.下列说法正确的是( ) A.CH4(g)+ O2(g)═CO(g)+2H2O(l)△H═﹣a kJ mol﹣1 , 这里△H代表燃烧热 B.在25℃、101kPa,1mol硫和2mol硫的燃烧热相等 C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2 , 所以CO的燃烧反应一定是吸热反应 D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 5.在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)△H=﹣57kJ mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( ) A.a、c两点的反应速率:a>c B.a、b两点的转化率:a<b C.a、c两点气体的颜色:a深,c浅 D.由a点到b点,可以用加热的方法 6.下列原电池对应的电极反应式正确的是( ) A.硫酸铅蓄电池的负极:Pb﹣2e﹣═Pb2+ B.锌银纽扣电池的正极:Ag2O+2e﹣+H2O═2AgOH C.碱性锌锰电池的负极:Zn﹣2e﹣+2OH﹣═Zn(OH2 D.氢氧碱性燃料电池的正极:2H2O+4e﹣═O2+4H+ 7.工业上可利用图所示电解装置吸收和转化SO2(A,B均为惰性电极).下列说法正确的是( ) A.A电极接电源的正极 B.A极区溶液的碱性逐渐增强 C.本装置中使用的是阴离子交换膜 D.B极的电极反应式为SO2+2e﹣+2H2O═SO42 +4H+ 8.在一定条件下,反应X(g)+3Y(g) 2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) 图中A,B两点,达到相同的平衡体系 B、上述反应在达到平衡后,增大压强,X的转化率提高 C、升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 D、将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ 9.在容积不变的密闭容器中进行反应:2SO2( g )+O2( g) 2SO3(g );△H<O.如图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( ) A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响 C、图Ⅱ表示t0时刻通入氦气对反应速率的影响 D、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 10.已知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如表: 温度/℃ 700 800 830 1 000 1 200 化学平衡常数 1.7 1.1 1.0 0.6 0.4 下列说法正确的是( ) 该反应为吸热反应 B.该反应的化学平衡常数表达式为K= C.其他条件不变时,增大体系的压强,化学平衡常数减小 D.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 你 11.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( ) A.NaCl是非电解质 B.NaCl溶液是电解质 C.NaCl溶液中水电 ... ...
~~ 您好,已阅读到文档的结尾了 ~~