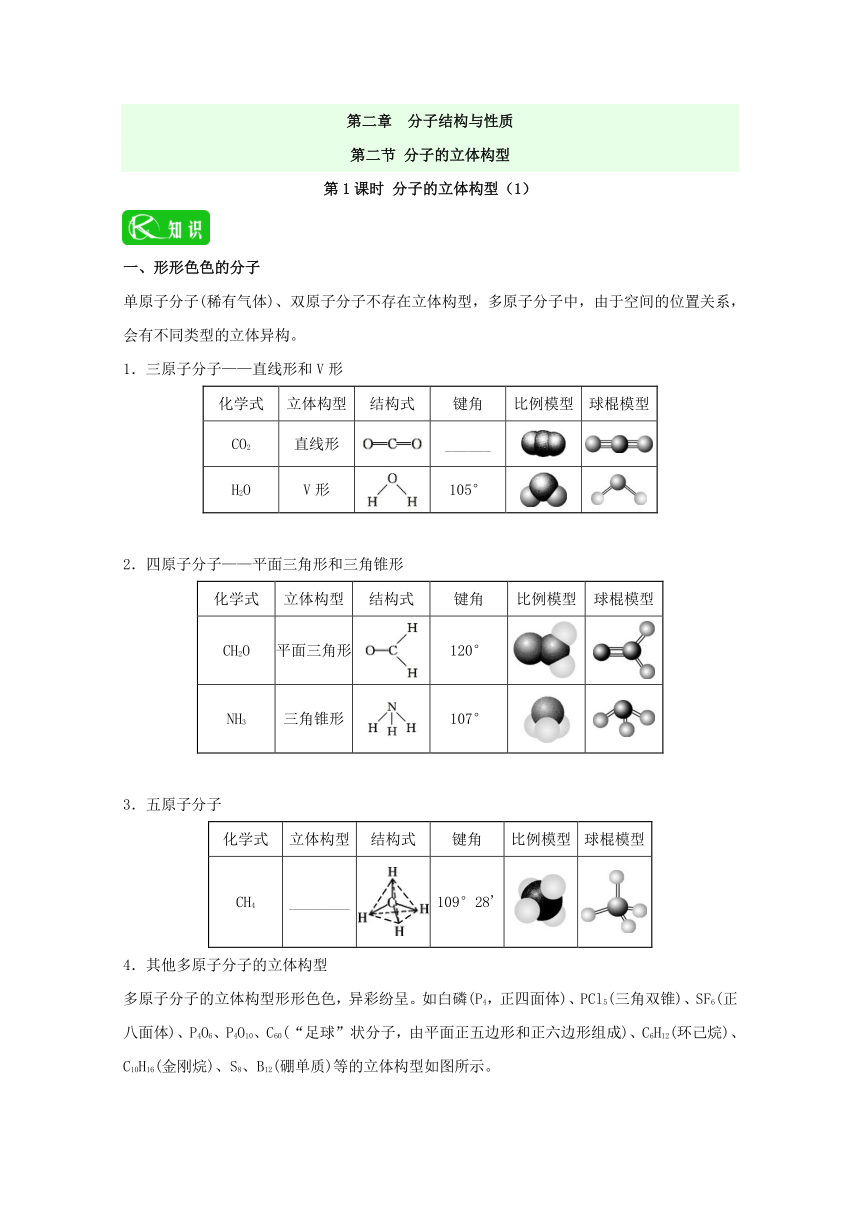
第二章 分子结构与性质 第二节 分子的立体构型 第1课时 分子的立体构型(1) 一、形形色色的分子 单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。 1.三原子分子———直线形和V形 化学式 立体构型 结构式 键角 比例模型 球棍模型 CO2 直线形 _____ H2O V形 105° 2.四原子分子———平面三角形和三角锥形 化学式 立体构型 结构式 键角 比例模型 球棍模型 CH2O 平面三角形 120° NH3 三角锥形 107° 3.五原子分子 化学式 立体构型 结构式 键角 比例模型 球棍模型 CH4 _____ 109°28' 4.其他多原子分子的立体构型 多原子分子的立体构型形形色色,异彩纷呈。如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(金刚烷)、S8、B12(硼单质)等的立体构型如图所示。 P4(正四面体) PCl5(三角双锥) SF6(正八面体) P4O6 P4O10 C60 椅式C6H12 船式C6H12 C10H16 S8 B12 二、价层电子对互斥理论 1.价层电子对互斥理论的含义 价层电子对互斥理论认为,分子的立体构型是价层电子对_____的结果,价层电子对是指分子中的中心原子上的电子对,包括_____和中心原子上的_____(未形成共价键的电子对)。 分子中的价层电子对由于_____作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。电子对之间的夹角越大,排斥力_____。 2.价层电子对互斥模型 电子对数 成键电子对数 孤电子对数 价层电子对立体构型 分子的立体构型 典例 2 2 0 直线形 直线形 BeCl2 3 3 0 三角形 三角形 BF3 2 1 V形 SnBr2 4 4 0 四面体 _____ CH4 3 1 三角锥形 NH3 2 2 V形 H2O 3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。 (1)当中心原子上无孤电子对时,二者的构型一致; (2)当中心原子上有孤电子对时,二者的构型不一致。 【答案】180° 正四面体形 相互排斥 σ键电子对 孤电子对 排斥力 越小 正四面体形 一、分子立体构型的确定 利用VSEPR理论预测分子立体构型的思路:σ键电子对数+孤电子对数=价层电子对数VSEPR模型分子的立体构型。其中正确地确定σ键数和a、x、b的值是计算价电子对数的关键,也是判断、预测VSEPR模型和立体构型的关键。一些常见的分子、离子的价层电子对数和立体构型如下表。 分子或离子 σ键电 子对数 中心原子上的孤电子对数 价层电 子对数 立体构型 a x b (a?xb) 分 子 CO2 2 4 2 2 0 2 直线形 BeCl2 2 2 2 1 0 2 直线形 SO2 2 6 2 2 1 3 V形 SO3 3 6 3 2 0 3 平面三角形 NH3 3 5 3 1 1 4 三角锥形 H2O 2 6 2 1 2 4 V形 CH4(CCl4) 4 4 4 1 0 4 正四面体形 离 子 H3O+ 3 6?1=5 3 1 1 4 三角锥形 3 4+2=6 3 2 0 3 平面三角形 4 6+2=8 4 2 0 4 正四面体形 3 7+1=8 3 2 1 4 三角锥形 注意:当中心原子无孤电子对时,VSEPR模型与分子的立体构型一致;当中心原子有孤电子对时,VSEPR模型与分子的立体构型不一致。 运用价电子对互斥理论的注意事项 1.利用价层电子对互斥理论判断分子的立体构型时应注意:价层电子对互斥理论模型是电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。�2.二者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时,二者的构型一致;当中心原子上有孤电子对时,二者的构型不一致。 用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小。下列判断正确的是 A.SO2、CS2、HI都是直线形的分子 B.BF3键角为120°,SnBr2键角大于120° C.COCl2、BF3、SO3都是平面三角形的分子 D.PCl ... ...
~~ 您好,已阅读到文档的结尾了 ~~