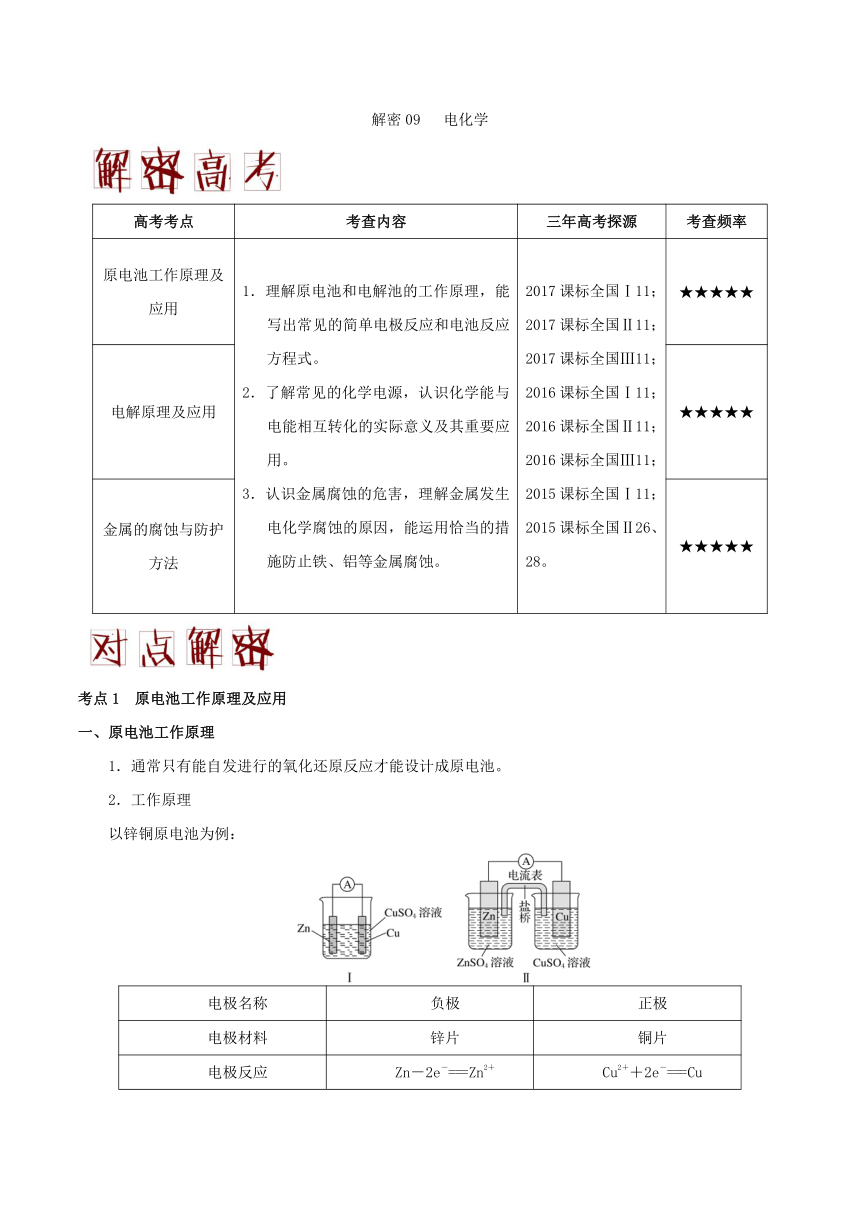
解密09 电化学 高考考点 考查内容 三年高考探源 考查频率 原电池工作原理及应用 1.理解原电池和电解池的工作原理,能写出常见的简单电极反应和电池反应方程式。 2.了解常见的化学电源,认识化学能与电能相互转化的实际意义及其重要应用。 3.认识金属腐蚀的危害,理解金属发生电化学腐蚀的原因,能运用恰当的措施防止铁、铝等金属腐蚀。 2017课标全国Ⅰ11; 2017课标全国Ⅱ11; 2017课标全国Ⅲ11; 2016课标全国Ⅰ11; 2016课标全国Ⅱ11; 2016课标全国Ⅲ11; 2015课标全国Ⅰ11; 2015课标全国Ⅱ26、28。 ★★★★★ 电解原理及应用 ★★★★★ 金属的腐蚀与防护方法 ★★★★★ 考点1 原电池工作原理及应用 一、原电池工作原理 1.通常只有能自发进行的氧化还原反应才能设计成原电池。 2.工作原理 以锌铜原电池为例: 电极名称 负极 正极 电极材料 锌片 铜片 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 氧化反应 还原反应 电子流向 由Zn沿导线流向Cu 盐桥中离子移向 盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极 盐桥的作用 (1)平衡电荷(2)避免断路时发生化学腐蚀(隔离作用) 说明 (1)无论是装置Ⅰ还是装置Ⅱ,电子均不能通过电解质溶液。 (2)在装置Ⅰ中,由于不可避免会直接发生Zn+Cu2+===Cu+Zn2+而使化学能转化为热能,所以装置Ⅱ的能量转化率高。 二、常见的化学电源 1.一次电池 普通锌锰电池 碱性锌锰电池 装置 电极 反应 负极:Zn?2e?Zn2+ 正极:2+2MnO2+2e?2NH3+Mn2O3+H2O 总反应: Zn+2MnO2+2Zn2++2NH3+Mn2O3+H2O 负极:Zn+2OH??2e?Zn(OH)2 正极:2MnO2+2H2O+2e?2MnOOH +2OH? 总反应: Zn + 2MnO2+2H2O2MnOOH+ Zn(OH)2 特点 优点:制作简单,价格便宜; 缺点:新电池会发生自动放电,使存放时间缩短,放电后电压下降较快 优点:克服了普通锌锰干电池的缺点,单位质量所输出的电能多且储存时间长,适用于大电流和连续放电 2.二次电池 铅蓄电池是最常见的二次电池 ① 放电时的电极反应 负极:Pb(s)+(aq)?2e?PbSO4(s) (氧化反应) 正极:PbO2(s)+4H+(aq)+(aq)+2e?PbSO4(s)+2H2O(l) (还原反应) 总反应:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l) ② 充电时的电极反应 阴极:PbSO4(s)+2e?Pb(s)+(aq) (还原反应)? 阳极:PbSO4(s)+2H2O(l)?2e?PbO2(s)+4H+(aq)+(aq) (氧化反应)? 总反应:2PbSO4(s)+2H2O(l)Pb(s)+PbO2(s)+2H2SO4(aq) 3.燃料电池 是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。燃料电池的优点:能量转换率高、废弃物少、运行噪音低。 (1)氢氧燃料电池 氢氧燃料电池是目前最成熟的燃料电池,可分酸性和碱性两种。 装置 电池总反应 2H2+O22H2O 介 质 酸性 (H+) 负极:2H2?4e?4H+ 正极:O2+4H++4e?2H2O 中性 (Na2SO4) 负极:2H2?4e?4H+ 正极:O2+2H2O+4e?4OH? 碱性 (OH?) 负极:2H2+4OH??4e?4H2O 正极:O2+2H2O+4e?4OH? (2)甲醇燃料电池 甲醇燃料电池以铂为两极,用碱或酸作为电解质: ①碱性电解质(KOH溶液为例) 总反应式:2CH3OH + 3O2 +4KOH=== 2K2CO3 + 6H2O 正极的电极反应式为:3O2 + 12e? + 6H2O===12OH? 负极的电极反应式为:CH3OH – 6e? +8OH? === CO32?+ 6H2O ②酸性电解质(H2SO4溶液为例) 总反应:2CH3OH +3O2 ===2CO2 + 4H2O 正极的电极反应式为:3O2+12e?+12H+ === 6H2O 负极的电极反应式为:2CH3OH ?12e?+2H2O ===12H++ 2CO2 说明:乙醇燃料电池与甲醇燃料电池原理基本相同。 (3)甲烷燃料电池 甲烷燃料电池以多孔镍板为两极,电解质溶液为KOH,生成的CO2还要与KOH反应生成K2CO3,所以总反应为:CH4 + 2KOH+ 2O2=== K2CO3+3H2O。 负极发生的反应:CH4? 8e? +8OH?===CO2 + 6H2O、CO2 + 2OH?===CO32? + H2O,所以: 负极的电极反应式为:C ... ...
~~ 您好,已阅读到文档的结尾了 ~~

