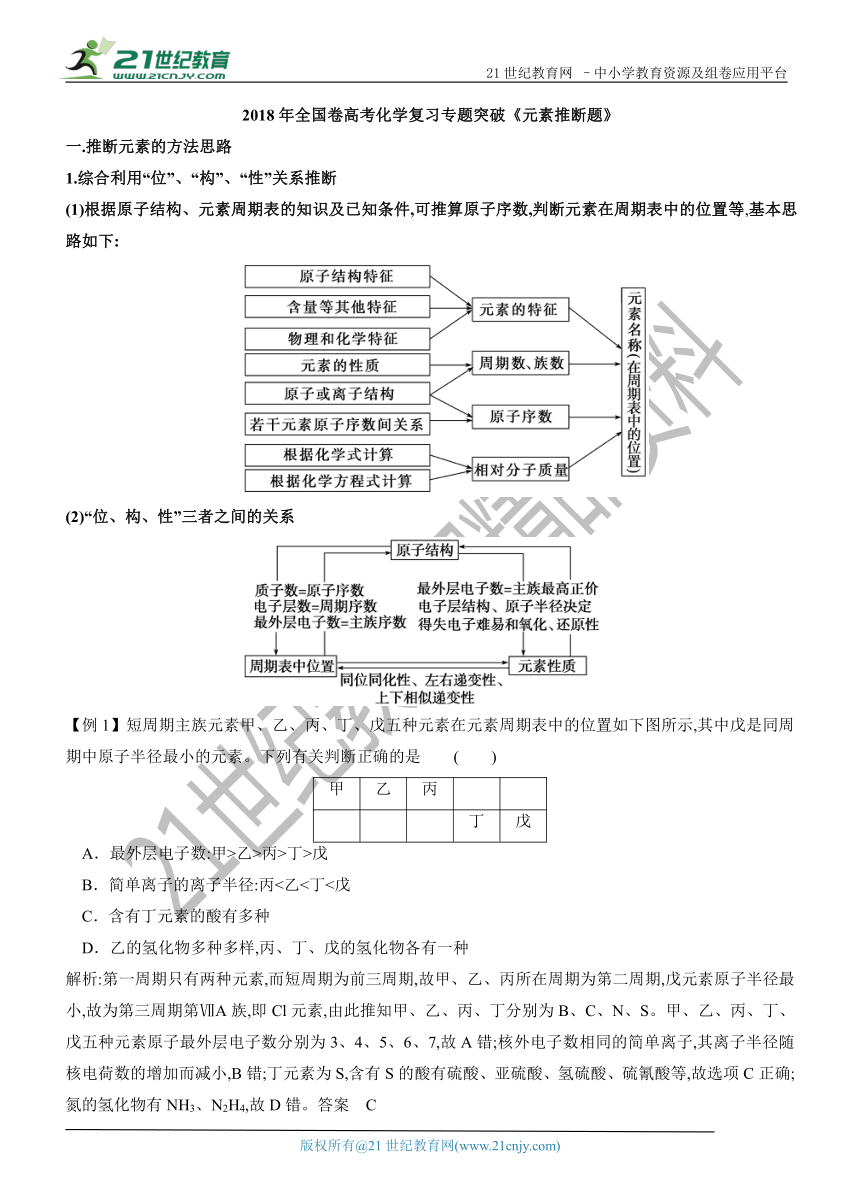
21世纪教育网 –中小学教育资源及组卷应用平台 2018年全国卷高考化学复习专题突破《元素推断题》 一.推断元素的方法思路 1.综合利用“位”、“构”、“性”关系推断 (1)根据原子结构、元素周期表的知识及已知条件,可推算原子序数,判断元素在周期表中的位置等,基本思路如下:2·1·c·n·j·y (2)“位、构、性”三者之间的关系 【例1】短周期主族元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是 ( ) 甲 乙 丙 丁 戊 A.最外层电子数:甲>乙>丙>丁>戊 B.简单离子的离子半径:丙<乙<丁<戊 C.含有丁元素的酸有多种 D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 解析:第一周期只有两种元素,而短周期为前三周期,故甲、乙、丙所在周期为第二周期,戊元素原子半径最小,故为第三周期第ⅦA族,即Cl元素,由此推知甲、乙、丙、丁分别为B、C、N、S。甲、乙、丙、丁、戊五种元素原子最外层电子数分别为3、4、5、6、7,故A错;核外电子数相同的简单离子,其离子半径随核电荷数的增加而减小,B错;丁元素为S,含有S的酸有硫酸、亚硫酸、氢硫酸、硫氰酸等,故选项C正确;氮的氢化物有NH3、N2H4,故D错。答案 C 【例2】下表是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题: (1)写出j在周期表中的位置_____。 (2)o、i、p三种元素之间能以原子个数之比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出i、p的互化物与f、l形成的化合物等物质的量反应时的化学方程式:_____。 (3)假设NH是“元素NH4”的阳离子,则“元素NH4”在周期表中的位置应该是_____;NH4的碳酸盐应_____(填“易”或“不易”)溶于水。 解析:(1)由元素周期表的结构知,j处于第四周期,周期表的第4个横行的结构包括,第ⅠA~ⅡA族、第ⅢB~ⅦB族、第Ⅷ族、第ⅠB~ⅡB族、第ⅢA~ⅦA族部分元素,j是第Ⅷ族。 (2)由题意知i、p的互化物为BrCl,f、l形成的化合物为NaI,BrCl中Cl得电子能力强,Cl为-1价,Br为+1价,类似于卤素单质的性质,NaI与BrCl等物质的量反应生成I2。 (3)NH4的核电荷数为11,周期表中应在第三周期第ⅠA族,类似于钠,NH4的碳酸盐易溶于水。 答案 (1)第四周期第Ⅷ族 (2)2BrCl+2NaI===Br2+I2+2NaCl (3)第三周期第ⅠA族 易 2.根据原子序数推断元素在周期表中的位置 记住稀有气体元素的原子序数:2、10、18、36、54、86.用原子序数减去比它原子序数小而相近的稀有气体元素原子序数,即得该元素所在的纵列数.第1、2纵列为第IA、第IIA族,第3~7纵列为第IIIB~第VIIB族,第8~10纵列为第VIII族,第11、12纵列为第IB、第IIB族,第13~17纵列为第IIIA~第VIIA族,第18纵列为0族.这种元素的周期数比相近的原子序数小的稀有气体元素的周期数大1. 如26号元素在周期表中的位置推断:26-18=8,故其位于第四周期第VIII族. 方法技巧:如果是第六周期以上的元素,用原子序数减去比它小而相近的稀有气体元素原子序数后,再减去14即得该元素所在的纵列数.如84号元素所在的周期和族的推导:84-54-14=16,即在16纵列,可判断位于第六周期第VIA族.上述方法也可作如下变通:同周期稀有气体元素原子序数-该元素原子序数=18-该元素所在的纵列数,如推断114号元素所处的位置:118-114=4(倒数第5纵列),即位于第七周期第IVA族. 3.根据核外电子的排布规律 (1)最外层电子规律 最外层电子数(N) 3≤N<8 N=1或2 N>次外层电子数 元素在周期表中的位置 主族 第ⅠA族、第ⅡA族、第Ⅷ族、副族、0族元素氦 第二周期 (2)“阴三阳四”规律 某元素阴离子最外层电子数与次外层相同,该元素位于第三周期.若为阳离子,则位于第四周期. (3)“阴上阳下”规律 电子层结构相同的离子,若电性相同,则位于同周期;若电性不同, ... ...
~~ 您好,已阅读到文档的结尾了 ~~