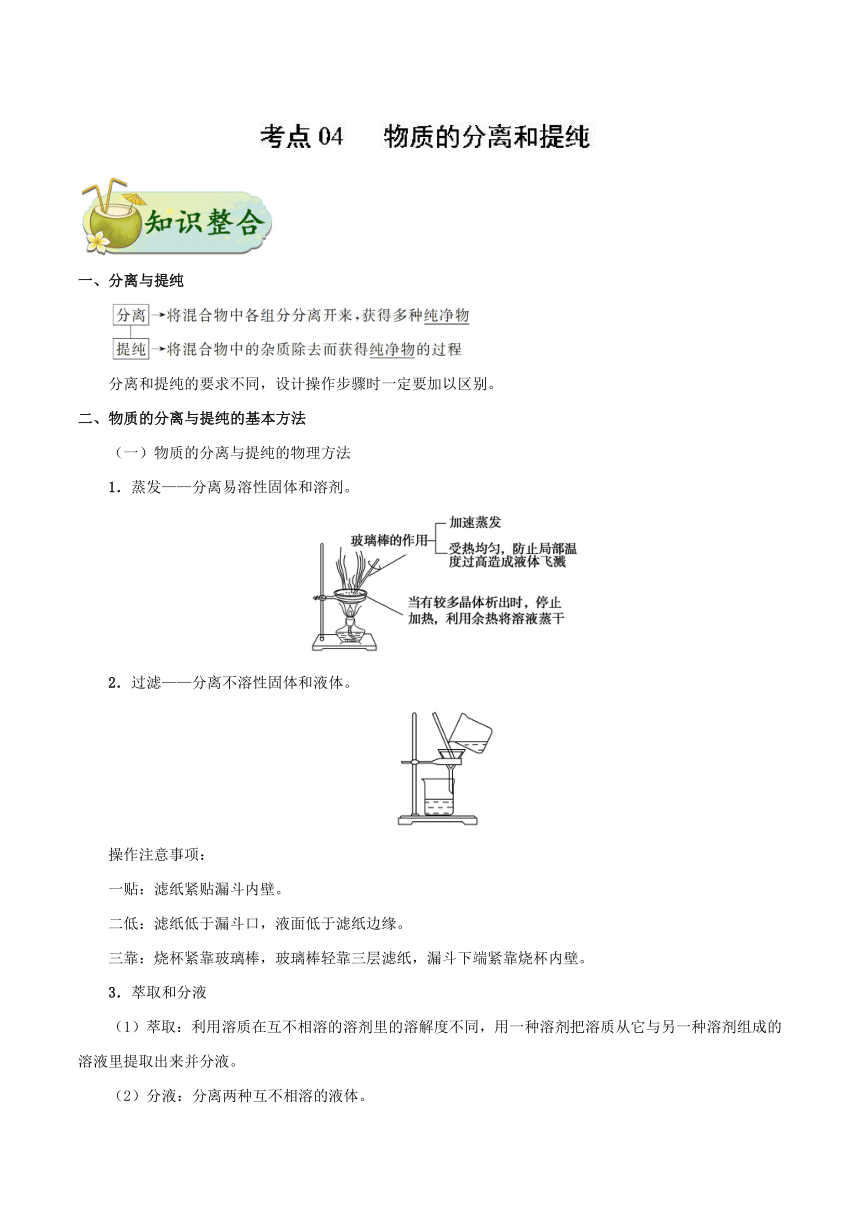
一、分离与提纯 分离和提纯的要求不同,设计操作步骤时一定要加以区别。 二、物质的分离与提纯的基本方法 (一)物质的分离与提纯的物理方法 1.蒸发———分离易溶性固体和溶剂。 2.过滤———分离不溶性固体和液体。 操作注意事项: 一贴:滤纸紧贴漏斗内壁。 二低:滤纸低于漏斗口,液面低于滤纸边缘。 三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸,漏斗下端紧靠烧杯内壁。 3.萃取和分液 (1)萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来并分液。 (2)分液:分离两种互不相溶的液体。 ①萃取剂须具备的条件:溶质在萃取剂中的溶解度比在原溶剂中要大得多;萃取剂与原溶剂互不相溶;萃取剂与溶质不发生反应。 ②分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。 4.蒸馏(或分馏)———分离沸点不同,且相互混溶的两种(或几种)液体。 5.升华———分离易升华与不升华的固体混合物。 6.渗析———用半透膜使离子或小分子从胶体中分离出来,如除去淀粉胶体中的NaCl。 将要提纯的胶体装入半透膜袋中,将袋系好,浸入蒸馏水中,并不断更换蒸馏水,渗析时间要充分。 7.盐析法(盐析后过滤)———将胶体从混合物中分离。 实例:蛋白质溶液中加饱和(NH4)2SO4。 (二)物质的分离与提纯的化学方法 方法 适用条件 举例 加热法 混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去 纯碱中混有小苏打 洗气法 将气体混合物通过洗气装置而除去杂质气体 让混合气体通过盛有饱和食盐水的洗气瓶除去Cl2中的少量HCl 沉淀法 在混合物中加入某试剂,使杂质离子以沉淀形式分离出去的方法 加适量AgNO3溶液除去KNO3溶液中的KCl 转化法 不能通过一次反应达到分离的目的时,要经过转化为其他物质才能分离,然后将转化物质恢复为原物质 分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3沉淀和Na[Al(OH)4]溶液,过滤后,向Fe(OH)3中加入盐酸重新生成Fe3+,向Na[Al(OH)4]中通入过量CO2,生成Al(OH)3沉淀,过滤后向Al(OH)3中加入盐酸重新生成Al3+ 酸碱法 被提纯物质不与酸碱反应,而杂质可与酸碱发生反应 用盐酸除去SiO2中的石灰石;用NaOH溶液除去铁粉中的铝粉 氧化还原法 ①对混合物中混有的还原性杂质,可加入适当的氧化剂使其被氧化为被提纯物质 ②对混合物中混有的氧化性杂质,可加入适当的还原剂将其还原为被提纯物质 将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡、过滤,可除去FeCl3杂质 调节pH法 通过加入试剂来调节溶液的pH,使溶液中某种成分沉淀分离的方法 CaCl2溶液中含有FeCl3杂质,由于FeCl3水解,溶液呈酸性,可采用调节溶液pH的方法将Fe3+沉淀,为此可加CaO或Ca(OH)2或CaCO3等 电解法 利用电解原理来分离、提纯物质 电解精炼铜 离子交换法 利用离子交换剂提纯物质 软化硬水 考向一 分离、提纯的原理与方法 典例1 《炼丹秘诀》中的“抽汞法”有如下叙述:“朱砂不计多少。入沙锅中以炭屑填平锅口,剪蛎壳板如锅大密钻小窍盖之,却将空沙锅一个与前锅二口相合,铁丝固济(包括有用铁丝缠和用盐泥固济二法),地下掘一穴安埋空锅,锻炼之后候冷取出,大概银朱一两只有真汞三钱。”文中涉及的操作方法是 A.蒸馏 B.升华 C.干馏 D.萃取 【答案】A 1.下列实验中,所采取的分离方法与对应原理都正确的是 选项 目的 分离方法 原理 A 除去KCl中的MnO2 蒸发结晶 溶解度不同 B 除去碘中的NaCl 加热、升华 NaCl的熔点高,碘易升华 C 分离KNO3和NaCl 重结晶 KNO3的溶解度大于NaCl D 分离食用油和汽油 分液 食用油和汽油的密度不同 混合物分离、提纯的物理方法归纳 考向二 分离仪器或装置的识别和选择 典例1 下列实验的试剂、装置选用 ... ...
~~ 您好,已阅读到文档的结尾了 ~~