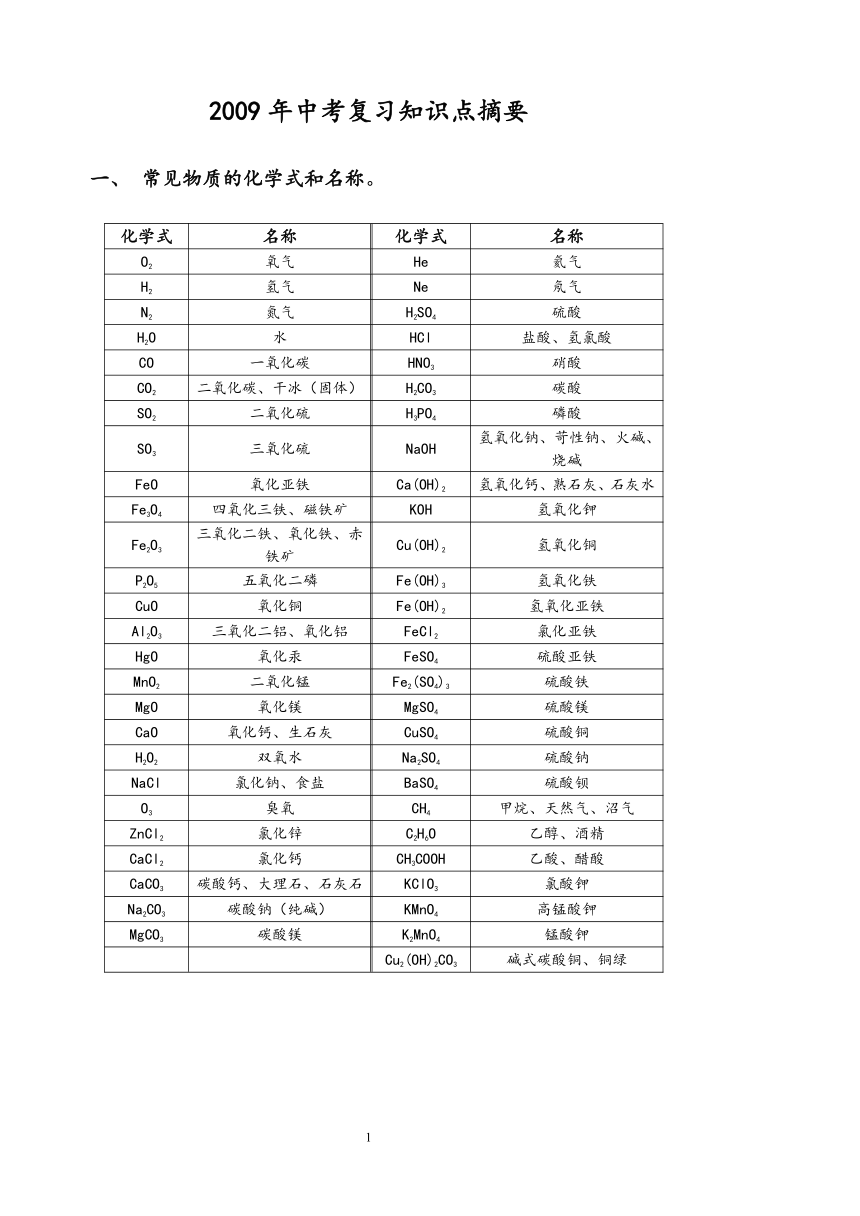
2009年中考复习知识点摘要 常见物质的化学式和名称。 化学式 名称 化学式 名称 O2 氧气 He 氦气 H2 氢气 Ne 氖气 N2 氮气 H2SO4 硫酸 H2O 水 HCl 盐酸、氢氯酸 CO 一氧化碳 HNO3 硝酸 CO2 二氧化碳、干冰(固体) H2CO3 碳酸 SO2 二氧化硫 H3PO4 磷酸 SO3 三氧化硫 NaOH 氢氧化钠、苛性钠、火碱、烧碱 FeO 氧化亚铁 Ca(OH)2 氢氧化钙、熟石灰、石灰水 Fe3O4 四氧化三铁、磁铁矿 KOH 氢氧化钾 Fe2O3 三氧化二铁、氧化铁、赤铁矿 Cu(OH)2 氢氧化铜 P2O5 五氧化二磷 Fe(OH)3 氢氧化铁 CuO 氧化铜 Fe(OH)2 氢氧化亚铁 Al2O3 三氧化二铝、氧化铝 FeCl2 氯化亚铁 HgO 氧化汞 FeSO4 硫酸亚铁 MnO2 二氧化锰 Fe2(SO4)3 硫酸铁 MgO 氧化镁 MgSO4 硫酸镁 CaO 氧化钙、生石灰 CuSO4 硫酸铜 H2O2 双氧水 Na2SO4 硫酸钠 NaCl 氯化钠、食盐 BaSO4 硫酸钡 O3 臭氧 CH4 甲烷、天然气、沼气 ZnCl2 氯化锌 C2H6O 乙醇、酒精 CaCl2 氯化钙 CH3COOH 乙酸、醋酸 CaCO3 碳酸钙、大理石、石灰石 KClO3 氯酸钾 Na2CO3 碳酸钠(纯碱) KMnO4 高锰酸钾 MgCO3 碳酸镁 K2MnO4 锰酸钾 Cu2(OH)2CO3 碱式碳酸铜、铜绿 二、记注下列物质的颜色 化学式 名称 颜色 化学式 名称 颜色 C 碳 黑色 Cu 铜 红色 CuO 氧化铜 黑色 KCl 氯化钾 白色 Fe3O4 四氧化三铁 黑色 KClO3 氯酸钾 白色 MnO2 二氧化锰 黑色 KMnO4 高锰酸钾 紫黑色 Fe2O3 三氧化二铁 红色 K2MnO4 锰酸钾 绿色 Fe(OH)3 氢氧化铁 红褐色 Cu2(OH)2CO3 碱式碳酸铜 绿色 Cu(OH)2 氢氧化铜 蓝色 Fe(OH)2 氢氧化亚铁 绿色 CuSO4 硫酸铜(溶液) 蓝色 FeSO4 硫酸亚铁 浅绿色 三、常见的原子团: 物质 HNO3 NaOH H2SO4 H2CO3 NH4Cl KClO3 KMnO4 K2MnO4 原子团名 硝酸根 氢氧根 硫酸根 碳酸根 铵根 氯酸根 高锰酸根 锰酸根 符号 NO3- OH- SO42- CO32- NH4+ ClO32- MnO4- MnO42- 化合价 NO3 OH SO4 CO3 NH4 ClO3 MnO4 MnO4 四、要掌握的基本概念: 1、化学变化 2、物理变化 3、单质 4、化合物 5、纯净物 6、混合物 7、氧气物 8、催化剂 10、分子 11、原子 12、元素 13、离子 14、化学式 15、化学方程式 16、氧化反应 17、氧化剂 18、还原剂 19、酸 20、碱 21、盐 22、碱性氧化物 23、酸性氧化物 五、四种基本反应类型: 1.化合反应 2、分解反应 3、置换反应 4、复分解反应 六、不能共存的离子有 : H+ + OH- ═══ H2O Ba+ + SO42- ═══ BaSO4↓(白色沉淀) Ag+ + Cl- ═══ AgCl↓(白色沉淀) Fe3+ + OH- ═══ Fe (OH)3↓(红褐色沉淀) Cu2+ + OH- ═══ Cu(OH)2↓ (蓝色沉淀) H+ + CO32- ═══ H2O +CO2↑(CO2能使润湿的石蕊试纸变红) NH4+ + OH- ═══ H2O + NH3↑(NH3能使润湿的石蕊试纸变蓝) 七、记注下列物质的颜色: 记注:“ 一绿、二蓝、三红三白、四黑”。 一绿:FeSO4为浅绿色。 二蓝:CuSO4为蓝色溶液、Cu(OH)2为蓝色沉淀。 三红:Cu为红色、Fe(OH)3为红褐色、Fe2O3为暗红色 三白:CaCO3为白色沉淀能溶于酸、BaSO4为白色沉淀且不溶于稀硝酸 、AgCl为白色沉淀且不溶于稀硝酸 四黑:C、CuO、 MnO2 Fe3O4等为黑色固体。 八.制取三种气体的五个化学方程式. 1.制取氧气的反应原理: 2H2O2=====2H2O + 2O2↑ 2KMnO4===== K2MnO4 + MnO2 +O2↑ 2.制取氢气的反应原理: Zn + H2SO4 ===== ZnSO4 + H2↑ Zn + 2HCl ===== ZnCl2 + H2↑ 3.制取二氧化碳的反应原理: CaCO3 +2HCl ===== CaCl2 + H2O + CO2↑ 九.熟记四个表 1、元素符号表 2、化合价表 3、金属活动顺序表 4、酸、碱、盐的溶解性表 十.物质的分离和提纯: 1.分离是使混合物中的各组成成份分开,并且最终要保持各组成成分在原混合物中的原有状态,从而得到纯净物. 分离的方法有物理方法和化学方法,也可两种方法综合使用. ... ...
~~ 您好,已阅读到文档的结尾了 ~~

