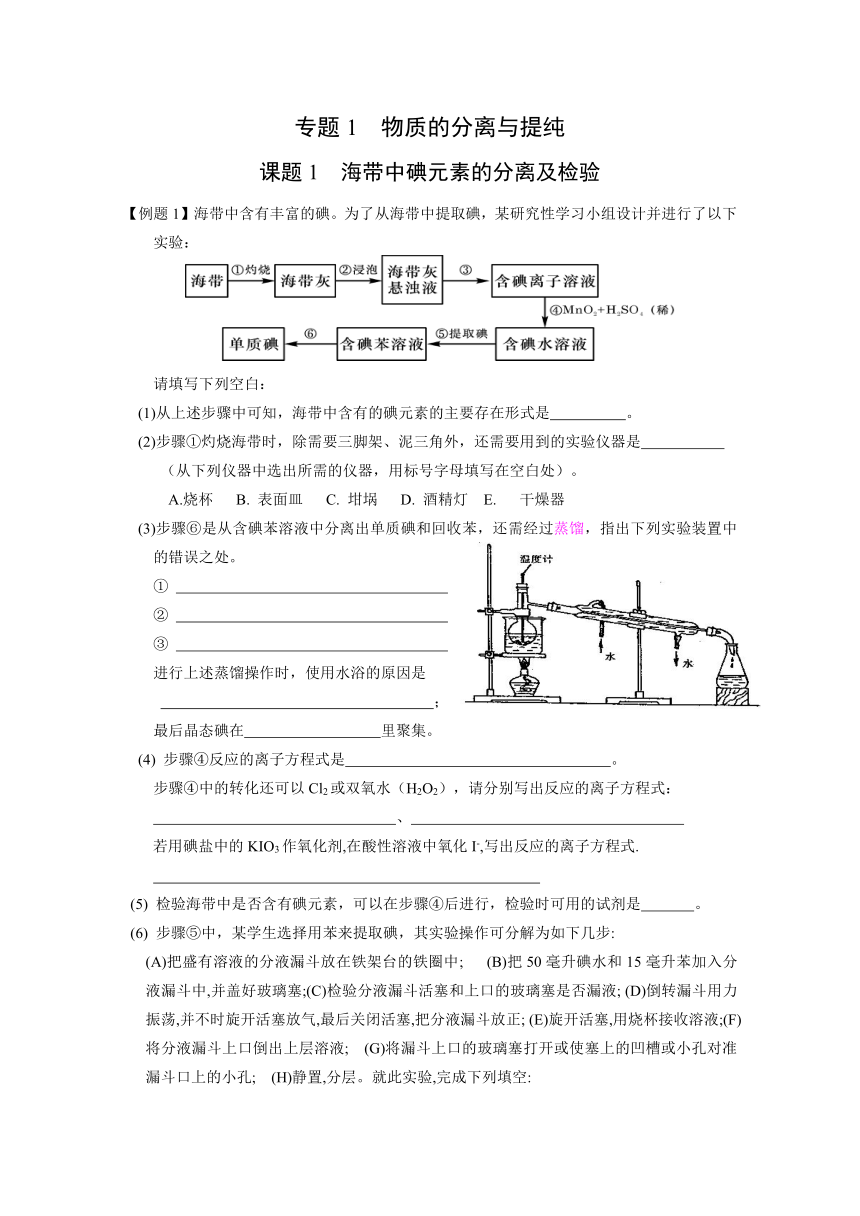
专题1 物质的分离与提纯 课题1 海带中碘元素的分离及检验 【例题1】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 请填写下列空白: (1)从上述步骤中可知,海带中含有的碘元素的主要存在形式是 。 (2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。 A.烧杯 B. 表面皿 C. 坩埚 D. 酒精灯 E. 干燥器 (3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出下列实验装置中的错误之处。 ① ② ③ 进行上述蒸馏操作时,使用水浴的原因是 ; 最后晶态碘在 里聚集。 (4) 步骤④反应的离子方程式是 。 步骤④中的转化还可以Cl2或双氧水(H 2O2),请分别写出反应的离子方程式: 、 若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I-,写出反应的离子方程式. (5) 检验海带中是否含有碘元素,可以在步骤④后进行,检验时可用的试剂是 。 (6) 步骤⑤中,某学生选择用苯来提取碘,其实验操作可分解为如下几步: (A)把盛有溶液的分液漏斗放在铁架台的铁圈中; (B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;(C)检验分液漏斗活塞和上口的玻璃塞是否漏液; (D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; (E)旋开活塞,用烧杯接收溶液;(F)将分液漏斗上口倒出上层溶液; (G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔; (H)静置,分层。就此实验,完成下列填空: ①正确操作步骤的顺序是 → → →A→G→ →E→F ②上述(E)步骤的操作中应注意 上述(G)步骤操作的目的是 ③能选用苯从碘水中萃取碘的原因是 ④下列物质,不能作为从碘水中萃取碘的溶剂的是 (A)热裂汽油 (B)CCl4 (C)酒精 (D)甲苯 (7)步骤③得到的溶液有时候仍是浑浊的,其通常原因是 。 【例2】在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单 质碘: ④稀H2SO4浸洗 溶液 ⑤加稀HNO3 溶液 ①加AgNO3溶液 ③加适量Fe屑、水 ②过滤、水洗 搅拌 ⑥通适量Cl2 弃去母液 ⑦提纯 回答: (1)乙、丁中溶质的分子式:乙 ,丁 (2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号) a除去未反应的NO3-- b除去未反应的I- c除去未反应的Fe d 除去碱性物质 (3)第⑦步操作可供提纯的方法是 (不要求写具体步骤)。 (4)实验室检验I2 的方法是 (5)甲物质见光易变黑,其原因是(用化学方程式表示) (6)上述工艺流程中可以得到的副产品主要有 。可以循环利用的物质是 。 (7)写出步骤⑥的离子反应方程式 。 写出步骤⑤的化学方程式 。 (6)有人认为,此工艺流程没有必须搞得这样复杂,只要在富碘卤水中直接通入适量Cl2,再进行第⑦步的实验操作即可,你这样看待这个观点。 (7)物质的分离和提纯有许多方法,通常是根据样品的性质和状态来确定的,结合所学知识,填写下表: 样品的性质和状态 实验方法的选择 固体样品 液体样品 胶体样品 气体样品 参考答案 【例题1】 (1)I— (2)C D (3) 三个错误之处: ①温度计水银球位置没有放在蒸馏烧瓶的支管口 ②冷凝管中的水流方向错误 ③加热时在烧杯上没有垫石棉网 使用水浴的原因: 受热均匀 ②容易控制反应温度 ③ 反应温度低于100℃ 蒸馏烧瓶 (4) 2I —+4H++MnO2=I2+MnCl2+I2 2I —+Cl2=I2+ Cl_ 2I —+H2O2=I2+2H2O 5I —+6H++IO3-=I2+3 H2O (5)淀粉 (6)① C B D A G H E F ②分液漏斗下端与接受液体的烧杯内壁相贴;控制好活塞,注意液体的流速。 与大气相通,使液体顺利流下。 ③苯与水互不相溶;I2在苯中溶解度比在水中的大。 A C (7)滤纸可能破损; 液面高于滤纸边缘。 【例题2】 (1)FeI2 FeCl3 (2)C (3) ... ...
~~ 您好,已阅读到文档的结尾了 ~~