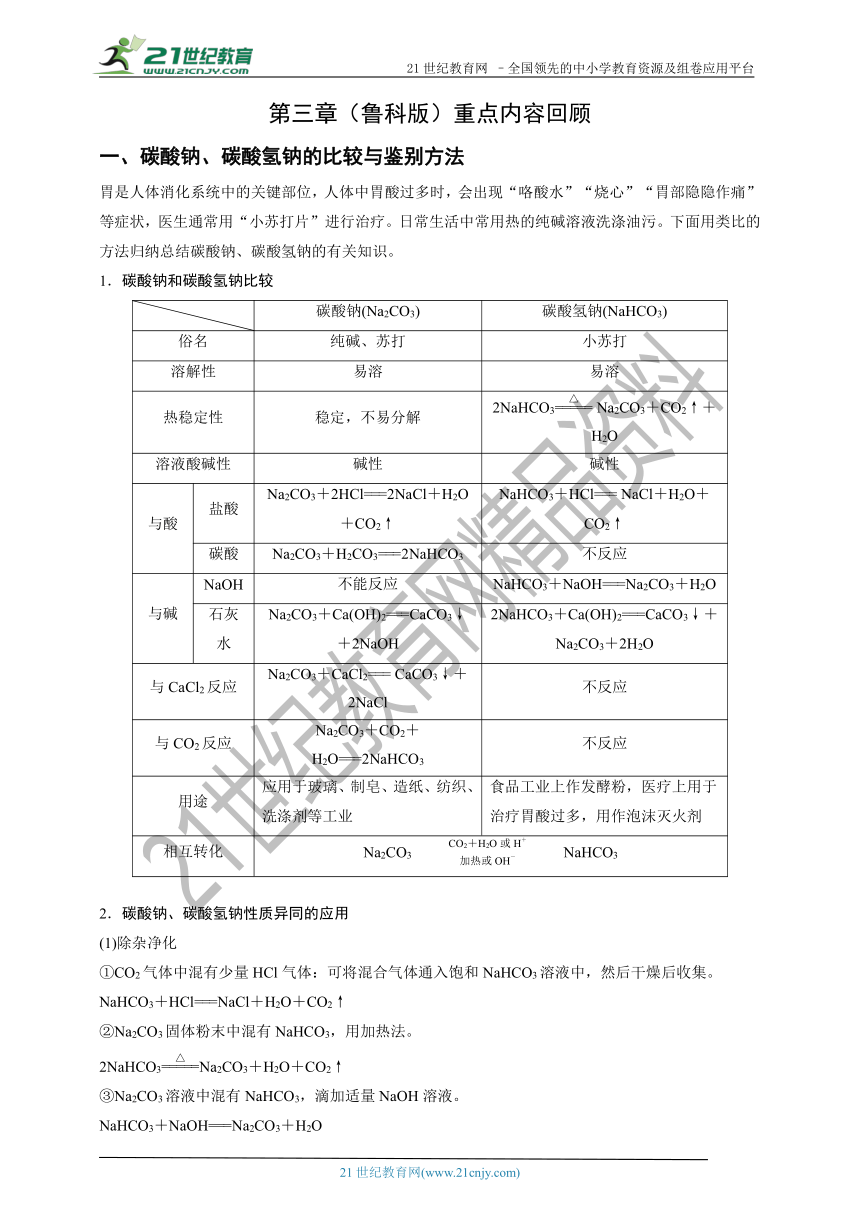
21世纪教育网 –全国领先的中小学教育资源及组卷应用平台 第三章重点内容回顾: 一、碳酸钠、碳酸氢钠的比较与鉴别方法 胃是人体消化系统中的关键部位,人体中胃酸过多时,会出现“咯酸水”“烧心”“胃部隐隐作痛”等症状,医生通常用“小苏打片”进行治疗。日常生活中常用热的纯碱溶液洗涤油污。下面用类比的方法归纳总结碳酸钠、碳酸氢钠的有关知识。 1.碳酸钠和碳酸氢钠比较 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 俗名 纯碱、苏打 小苏打 溶解性 易溶 易溶 热稳定性 稳定,不易分解 2NaHCO3 Na2CO3+CO2↑+H2O 溶液酸碱性 碱性 碱性 与酸 盐酸 Na2CO3+2HCl===2NaCl+H2O+CO2↑ NaHCO3+HCl=== NaCl+H2O+CO2↑ 碳酸 Na2CO3+H2CO3===2NaHCO3 不反应 与碱 NaOH 不能反应 NaHCO3+NaOH===Na2CO3+H2O 石灰水 Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O 与CaCl2反应 Na2CO3+CaCl2=== CaCO3↓+2NaCl 不反应 与CO2反应 Na2CO3+CO2+H2O===2NaHCO3 不反应 用途 应用于玻璃、制皂、造纸、纺织、洗涤剂等工业 食品工业上作发酵粉,医疗上用于治疗胃酸过多,用作泡沫灭火剂 相互转化 Na2CO3NaHCO3 2.碳酸钠、碳酸氢钠性质异同的应用 (1)除杂净化 ①CO2气体中混有少量HCl气体:可将混合气体通入饱和NaHCO3溶液中,然后干燥后收集。 NaHCO3+HCl===NaCl+H2O+CO2↑ ②Na2CO3固体粉末中混有NaHCO3,用加热法。 2NaHCO3Na2CO3+H2O+CO2↑ ③Na2CO3溶液中混有NaHCO3,滴加适量NaOH溶液。 NaHCO3+NaOH===Na2CO3+H2O ④NaHCO3溶液中混有Na2CO3,通入过量的CO2气体。 Na2CO3+CO2+H2O===2NaHCO3 (2)鉴别方法 ①固体受热法:将两种粉末加热,产生能使澄清石灰水变浑浊的气体的是NaHCO3,不产生气体的是Na2CO3。 ②CaCl2(或BaCl2)溶液:各取适量两待鉴别溶液分别于洁净的试管中,向两溶液中分别加入BaCl2(或CaCl2)溶液,产生白色沉淀的是Na2CO3,不产生白色沉淀的是NaHCO3。 ③用稀盐酸:各取适量两待鉴别溶液分别于洁净的试管中,分别逐滴加入稀盐酸,立即产生气体的是NaHCO3;开始无气泡,加入一定量稀盐酸后才开始产生气体的是Na2CO3。 【例1】 日常生活中,经常用到苏打(又叫纯碱)和小苏打两种物质。 (1)下列有关苏打和小苏打的叙述中不正确的是( ) A.苏打和小苏打都易溶于水 B.在受热的条件下,苏打比小苏打稳定 C.向苏打和小苏打中分别滴加等浓度的盐酸,苏打放出气体的速度比小苏打慢 D.相同质量的苏打和小苏打分别与足量等浓度的盐酸反应,苏打放出的气体比小苏打多 (2)欲除去小苏打溶液中少量的苏打杂质,加入的物质最适宜的是( ) A.过量的二氧化碳 B.足量的盐酸 C.适量的NaOH溶液 D.适量的Ca(HCO3)2溶液 (3)欲除去苏打粉中的小苏打杂质的方法是( ) A.加入盐酸 B.通入二氧化碳 C.加热 D.加入氢氧化钙 解析 根据Na2CO3和NaHCO3的相互转化关系得知,除去NaHCO3溶液中混有的Na2CO3,可采取往溶液中通入过量的二氧化碳的方法;除去Na2CO3固体中混有的NaHCO3的简易方法是加热。 答案 (1)D (2)A (3)C 二、氮的氧化物溶于水的计算方法 氮元素有五种正化合价:+1、+2、+3、+4、+5,六种氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5,除NO2为红棕色外,其余均为无色气体,氮的氧化物均有毒,都是大气污染物。NO2和NO有如下反应: 3NO2+H2O===2HNO3+NO ① 2NO+O2===2NO2 ② 4NO2+O2+2H2O===4HNO3 ③ 4NO+3O2+2H2O===4HNO3 ④ 1.NO和NO2的混合气体 NO和NO2的混合气体溶于水时仅涉及反应①: 可利用气体体积变化差值进行计算 V剩=V(NO)原+V(NO2) 2.NO2和O2的混合气体 NO2和O2的混合气体溶于水时涉及反应③: 其计算如下表: x= 0 反应情 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

