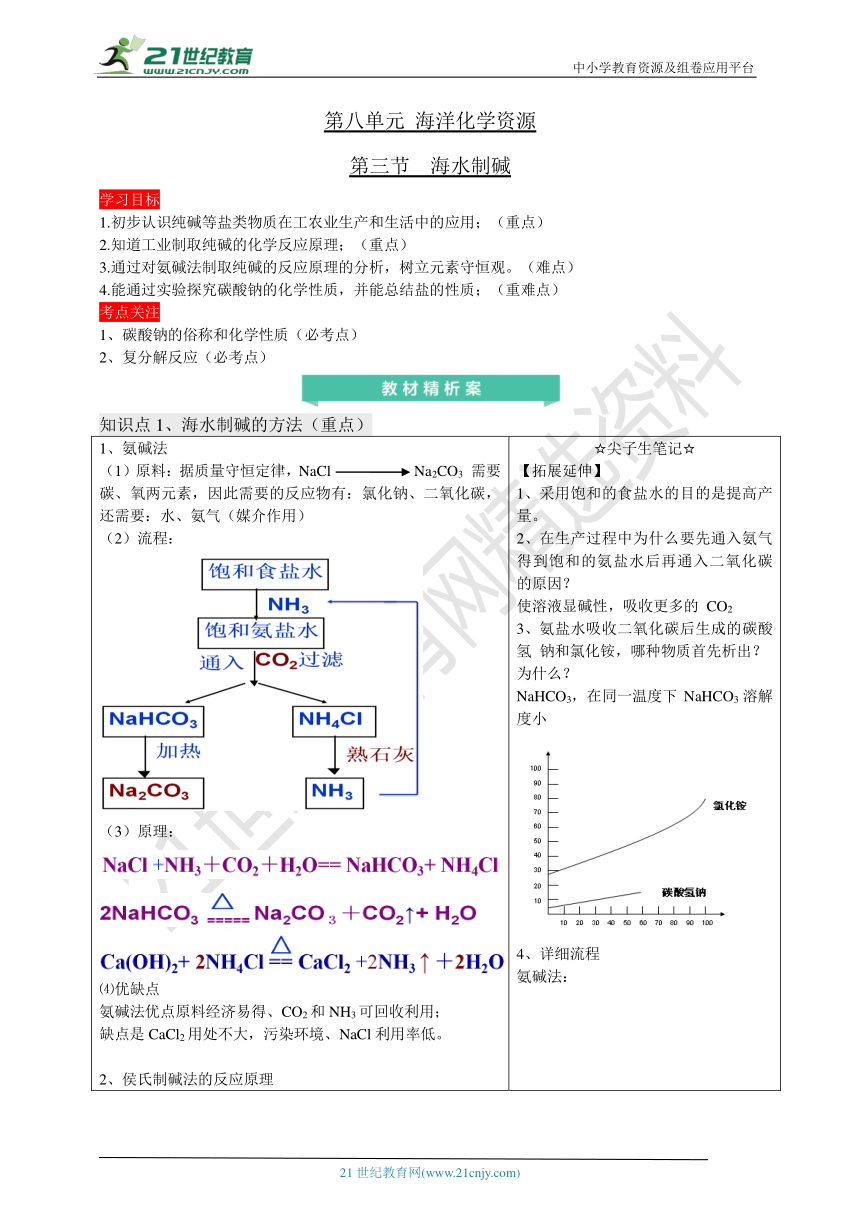
中小学教育资源及组卷应用平台 第八单元 海洋化学资源 第三节 海水制碱 学习目标 1.初步认识纯碱等盐类物质在工农业生产和生活中的应用;(重点) 2.知道工业制取纯碱的化学反应原理;(重点) 3.通过对氨碱法制取纯碱的反应原理的分析,树立元素守恒观。(难点) 4.能通过实验探究碳酸钠的化学性质,并能总结盐的性质;(重难点) 考点关注 1、碳酸钠的俗称和化学性质(必考点) 2、复分解反应(必考点) 知识点1、海水制碱的方法(重点) 1、氨碱法(1)原料:据质量守恒定律,NaCl Na2CO3 需要碳、氧两元素,因此需要的反应物有:氯化钠、二氧化碳,还需要:水、氨气(媒介作用)(2)流程:原理:⑷优缺点氨碱法优点原料经济易得、CO2和NH3可回收利用;缺点是CaCl2用处不大,污染环境、NaCl利用率低。侯氏制碱法的反应原理优点:向析出NaHCO3的母液(氯化铵)中加入研细的NaCl,使NH4Cl结晶析出,用作氮肥,氯化钠溶液可循环使用。这两种制碱方法有何异同 总原理相同:不同:对过滤出NaHCO3后的母液的处理方法 尖子生笔记【拓展延伸】采用饱和的食盐水的目的是提高产量。在生产过程中为什么要先通入氨气得到饱和的氨盐水后再通入二氧化碳的原因?使溶液显碱性,吸收更多的 CO2氨盐水吸收二氧化碳后生成的碳酸 氢 钠和氯化铵,哪种物质首先析出?为什么?NaHCO3,在同一温度下NaHCO3溶解度小详细流程氨碱法:侯氏制碱法:【漫画】 知识点2、碳酸钠与碳酸氢钠(重点) 小苏打治疗胃酸过多的原理: 知识点3、纯碱的化学性质(重点、难点) 1、纯碱的化学性质2、碳酸钠化学性质的应用除杂:除去氯化钠中的少量碳酸钠 方法:加入适量稀盐酸或氯化钙除氢氧化钠中少量碳酸钠 方法:加入适量氢氧化钙或氢氧化钡鉴别:用碳酸钠将盐酸、氯化钠、氢氧化钙三种溶液鉴别开: 方法:取三种溶液少量,分别滴入适量的碳酸钠溶液,生成白色沉淀的是氢氧化钙溶液,产生气泡的是盐酸,无明显现象的是氯化钠溶液。 【拓展延伸】【漫画】 知识点4、复分解反应的实质及碳酸根离子的验证(重点、难点) 2、盐的化学性质:3、碳酸根离子的检验: 【规律方法】沉淀口诀:钾、钠、硝酸、铵盐溶,盐酸除银、汞,硫酸除钡、铅,碳酸、磷酸只溶钾、钠、铵。【易错点津】【化学小常识】【拓展延伸】在溶液中不共存的离子有:【漫画】 题型1、碳酸钠化学性质的考察 【例1】(2017·来宾中考)现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如右图所示.下列说法正确的是( )A.滴至a克时,溶液中反应为CaCl2+Na2CO3=2NaCl+CaCO3↓B.滴至b克时,溶液中含HCl、NaCl两种溶质C.滴至c克时,溶液中溶质质量比原混合溶液中溶质质量大D.滴至d克时,溶液呈中性【解析】:A、滴至ag时,稀盐酸完全反应,溶液中反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑,该选项说法不正确;B、滴至bg时,溶液中不含HCl,含有反应生成的NaCl和没有反应的氯化钙两种溶质,该选项说法不正确;C、滴至cg时,氯化钙和碳酸钠完全反应,碳酸钠和稀盐酸、氯化钙反应的化学方程式及其质量关系为:Na2CO3+2HCl═2NaCl+H2O+CO2↑,73 117CaCl2+Na2CO3=2NaCl+CaCO3↓,111 117由以上质量关系可知,溶液中溶质质量比原混合溶液中溶质质量大,该选项说法正确;D、滴至dg时,溶液中的溶质是反应生成的氯化钠和过量的碳酸钠,碳酸钠溶液显碱性,因此溶液显碱性,该选项说法不正确.【答案】:C.【解题策略】熟记碳酸钠的化学性质:1、溶液呈碱性;2、能与酸反应生成二氧化碳、盐、水;3、能和某些可溶的盐溶液如氯化钙溶液反应生成沉淀;4、能与某些碱的溶液反应生成沉淀。 【针对性训练1】(2017·六盘水中考)甲、乙两名同学分别 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

