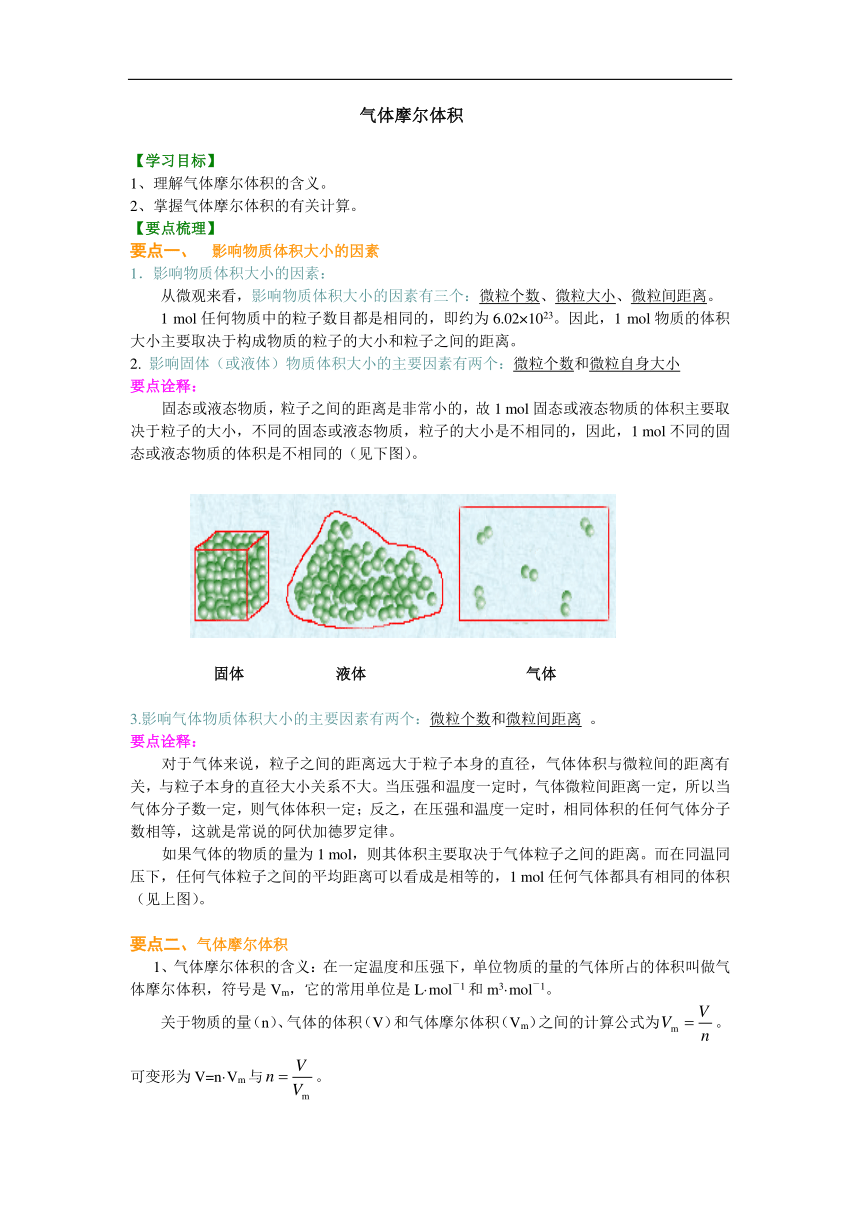
气体摩尔体积 【学习目标】�1、理解气体摩尔体积的含义。 2、掌握气体摩尔体积的有关计算。 【要点梳理】 要点一、 影响物质体积大小的因素 1.影响物质体积大小的因素:� 从微观来看,影响物质体积大小的因素有三个:微粒个数、微粒大小、微粒间距离。 1 mol任何物质中的粒子数目都是相同的,即约为6.02×1023。因此,1 mol物质的体积大小主要取决于构成物质的粒子的大小和粒子之间的距离。 2. 影响固体(或液体)物质体积大小的主要因素有两个:微粒个数和微粒自身大小 要点诠释: 固态或液态物质,粒子之间的距离是非常小的,故1 mol固态或液态物质的体积主要取决于粒子的大小,不同的固态或液态物质,粒子的大小是不相同的,因此,1 mol不同的固态或液态物质的体积是不相同的(见下图)。 / 固体 液体 气体 3.影响气体物质体积大小的主要因素有两个:微粒个数和微粒间距离 。 要点诠释: 对于气体来说,粒子之间的距离远大于粒子本身的直径,气体体积与微粒间的距离有关,与粒子本身的直径大小关系不大。当压强和温度一定时,气体微粒间距离一定,所以当气体分子数一定,则气体体积一定;反之,在压强和温度一定时,相同体积的任何气体分子数相等,这就是常说的阿伏加德罗定律。 如果气体的物质的量为1 mol,则其体积主要取决于气体粒子之间的距离。而在同温同压下,任何气体粒子之间的平均距离可以看成是相等的,1 mol任何气体都具有相同的体积(见上图)。 要点二、气体摩尔体积 1、气体摩尔体积的含义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,符号是Vm,它的常用单位是L·mol-1和m3·mol-1。 关于物质的量(n)、气体的体积(V)和气体摩尔体积(Vm)之间的计算公式为。可变形为V=n·Vm与。 2、标准状况下气体摩尔体积:在标准状况(指0℃、101 kPa,记作:STP)下,气体摩尔体积约为22.4 L·mol-1。 要点诠释: ①气体摩尔体积和标准状况下气体摩尔体积是两个不同的概念。前者是指单位物质的量气体所占的体积。后者是指标准状况下,1 mol气体所占的体积,这个体积数值约为22.4 L。所以用到22.4 L·mol-1时,通常是标准状况下的气体。 ②气体摩尔体积中的气体指任意气体,该气体可以是纯净物,也可以是混合物;纯净物中,可以是单质,也可以是化合物。如标准状况下。1 mol氢气和氯气的混合气体的体积约为22.4 L,所含的分子总数为NA个。 ③在掌握气体摩尔体积时要注意4个要点:(1)标准状况;(2)1mol;(3)任何气体,(包括单一气体或混合气体);(4)约22.4L。 3、气体体积(V)、气体摩尔体积(Vm)、气体的物质的量(n)之间关系为:/� 由n=N/NA和n=V/Vm,可将气体分子数与宏观气体体积之间联系起来。如标准状况下,11.2 L H2所含分子数为: /。 由一定条件下的密度和气体摩尔体积可以求出气体的摩尔质量:M=Vm·ρ 如标准状况下,ρ(O2)=1.429 g·L―1,则M (O2)=Vm·ρ(O2)=22.4 L·mol―1×1.429 g·L―1=32 g·mol―1。 4、标准状况下的相关计算。 M与Vm的关系:M=Vm·=22.4 g/mol; n与Vm的关系:; m与Vm的关系:; N与Vm的关系:。 要点三、阿伏加德罗定律及其推论� 1、定律内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子数。这一规律称为阿伏加德罗定律。�要点诠释: (1)阿伏加德罗定律只适用气体,对固体、液体物质不适用。� (2)只有温度、压强、体积都相同的气体,其分子数才相同。� (3)气体摩尔体积是阿伏加德罗定律的特殊情况和具体体现。 2.几个重要的推论:� (1)同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比。 (2)同温同压下,任何气体的体积比等于它们的物质的量之比。� (3)同 ... ...
~~ 您好,已阅读到文档的结尾了 ~~