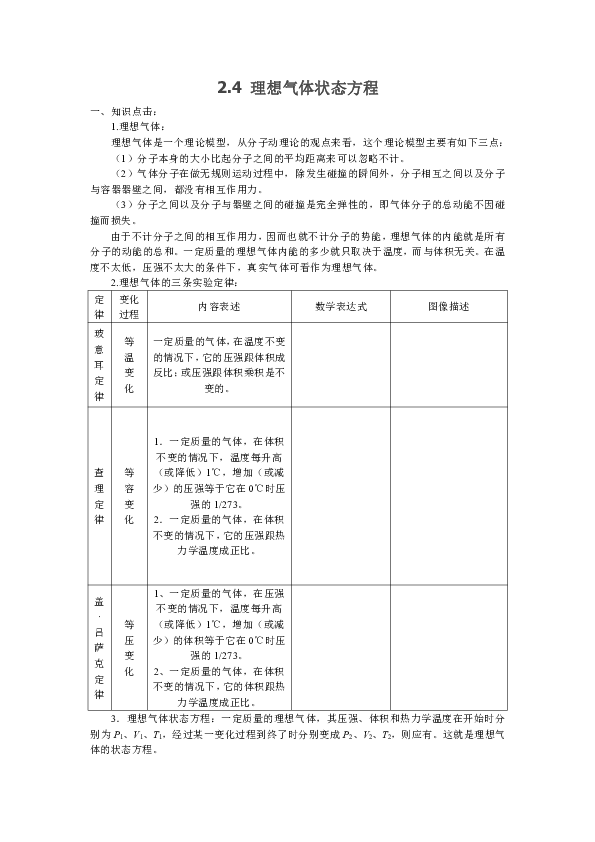
2.4 理想气体状态方程 一、知识点击: 1.理想气体: 理想气体是一个理论模型,从分子动理论的观点来看,这个理论模型主要有如下三点: (1)分子本身的大小比起分子之间的平均距离来可以忽略不计。 (2)气体分子在做无规则运动过程中,除发生碰撞的瞬间外,分子相互之间以及分子与容器器壁之间,都没有相互作用力。 (3)分子之间以及分子与器壁之间的碰撞是完全弹性的,即气体分子的总动能不因碰撞而损失。 由于不计分子之间的相互作用力,因而也就不计分子的势能,理想气体的内能就是所有分子的动能的总和。一定质量的理想气体内能的多少就只取决于温度,而与体积无关。在温度不太低,压强不太大的条件下,真实气体可看作为理想气体。 2.理想气体的三条实验定律: 定律 变化过程 内容表述 数学表达式 图像描述 玻意耳定律 等 温 变 化 一定质量的气体,在温度不变的情况下,它的压强跟体积成反比;或压强跟体积乘积是不变的。 查理定律 等 容 变 化 1.一定质量的气体,在体积不变的情况下,温度每升高(或降低)1℃,增加(或减少)的压强等于它在0℃时压强的1/273。 2.一定质量的气体,在体积不变的情况下,它的压强跟热力学温度成正比。 盖·吕萨克定律 等 压 变 化 1、一定质量的气体,在压强不变的情况下,温度每升高(或降低)1℃,增加(或减少)的体积等于它在0℃时压强的1/273。 2、一定质量的气体,在体积不变的情况下,它的体积跟热力学温度成正比。 3.理想气体状态方程:一定质量的理想气体,其压强、体积和热力学温度在开始时分别为P1、V1、T1,经过某一变化过程到终了时分别变成P2、V2、T2,则应有。这就是理想气体的状态方程。 理想气体的状态方程是根据三条气体实验定律中的任意两条(例如玻意耳定律和查理定律)推导而得的。 证明:如右图所示,a(b为等容变化,根据查理定律有P1/T1= Pc/T2,b(c为等温变化,根据波意耳定律有Pc·V1=P2·V2,两式联立起来,得到Pc=P1/T1·T2=P2·V2/ V1,变形得到。 二、能力激活: 题型一:图像的物理意义: 示例1:如图所示是a、b两部分气体的V-t图像,由图像可知:当t=0℃时,气体a的体积为 m3;当t=273℃时,气体a的体积比气体b的体积大 m3。 [分析]如图所示的V-t图像描述的是等压过程,由,可知t=273℃时,气体的体积是0℃时气体体积的两倍,则气体a的体积为0.6m3,气体b的体积为0.2m3。 [解析]气体a的体积比气体b的体积大0.6-0.2=0.4m3。 题型二:应用气体的P-V图、P-T(或P-t)图解题: 示例2:有两个容积相等的容器,里面盛有同种气体,用一段水平玻璃管把它们连接起来。在玻璃管的正中央有一段水银柱,当一个容器中气体的温度是0℃,另一个容器中气体的温度是20℃时,水银柱保持静止。如果使两容器中气体的温度都升高10℃,管中的水银柱会不会移动?如果移动的话,向哪个方向移动? [分析]一般解法是,选假定两边密闭容器中的气体体积暂不改变,根据查理定律,分别计算出两边气体各升温10℃后的压强,再比较两方压强的大小,就能判断水银柱会不会移动和向哪个方向移动。即 ∴P2>P2',因此水银柱应向原来温度高的那一侧移动。 这种解法如改用P-T(或P-t)图像来表述,将会更直观、鲜明。解题思路跟上面的一样,即先假定两边密闭容器中的气体体积暂不改变,分别根据查理定律P-T图上画出各自的等容线。如图所示。其中在分别为273K和293K的初温时气体压强相等即P0。再标出温度各自升高10K(10℃)后的压强值P2与P2',并与P0比较标明两侧压强的变化量(P与(P'。显然从图中可以看出,由于两条等容线的斜率不等,致使在相等的温度增量的情况下,压强的增量不等,(P>(P'。因此应有P2 (=P0+( P)>P2'(=P0+(P')的结论。即水银柱应向原来温度较高的那一侧移动 ... ...
~~ 您好,已阅读到文档的结尾了 ~~