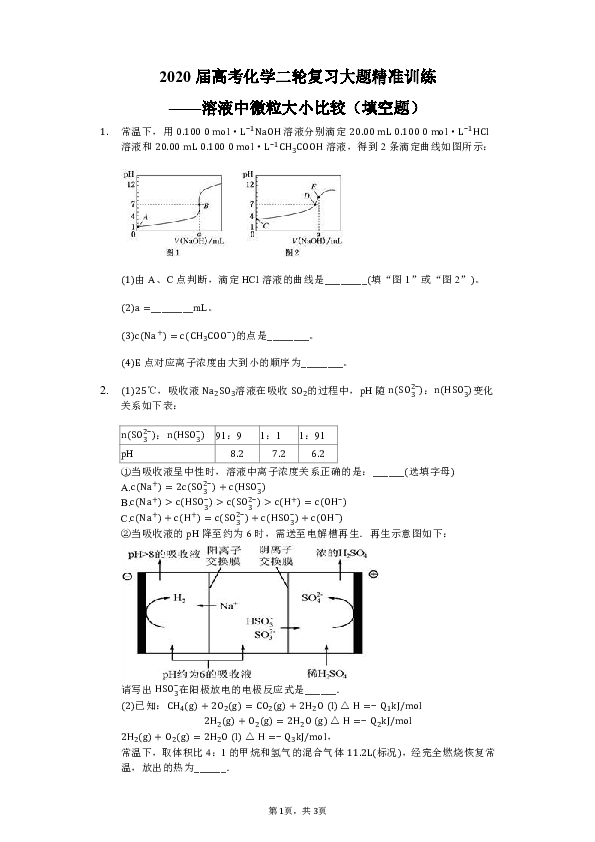
2020届高考化学二轮复习大题精准训练 ———溶液中微粒大小比较(填空题) 常温下,用0.100?0?mol· L ?1 NaOH溶液分别滴定20.00?mL?0.100?0?mol· L ?1 HCl溶液和20.00?mL?0.100?0?mol· L ?1 C H 3 COOH溶液,得到2条滴定曲线如图所示: (1)由A、C点判断,滴定HCl溶液的曲线是_____(填“图1”或“图2”)。 (2)a=_____mL。 (3)c(N a + )=c(C H 3 CO O ? )的点是_____。 (4)E点对应离子浓度由大到小的顺序为_____。 (1)25℃,吸收液N a 2 S O 3 溶液在吸收S O 2 的过程中,pH随n(S O 3 2? ):n(HS O 3 ? )变化关系如下表: n(S O 3 2? ):n(HS O 3 ? ) 91:9 1:1 1:91 pH 8.2 7.2 6.2 ①当吸收液呈中性时,溶液中离子浓度关系正确的是:_____(选填字母)�A.c(N a + )=2c(S O 3 2? )+c(HS O 3 ? )�B.c(N a + )>??(???? O 3 ? )>??(?? O 3 2? )>??( H + )=c(O H ? )�C.c(N a + )+c( H + )=c(S O 3 2? )+c(HS O 3 ? )+c(O H ? )�②当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: 请写出HS O 3 ? 在阳极放电的电极反应式是_____.�(2)已知:C H 4 (g)+2 O 2 (g)=C O 2 (g)+2 H 2 O?(l)△H=? Q 1 kJ/mol�2 H 2 (g)+ O 2 (g)=2 H 2 O?(g)△H=? Q 2 kJ/mol�2 H 2 (g)+ O 2 (g)=2 H 2 O?(l)△H=? Q 3 kJ/mol,�常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为_____. 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: HA物质的量浓度 /(mol· L ?1 ) NaOH物质的量浓度 /(mol· L ?1 ) 混合溶液的pH 0.1 0.1 pH=9 请回答: (1)实验所得混合溶液中由水电离出的c(O H ? )=_____mol· L ?1 。 (2)写出该混合溶液中下列算式的精确结果(不能做近似计算)。 c(N a + )?c( A ? )=_____mol· L ?1 c(O H ? )?c(HA)=_____mol· L ?1 常温下,用相同浓度的NaOH溶液分别滴定浓度均为0.1?mol· L ?1 的等体积的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示: 请按要求回答下列问题: (1)三种酸的电离常数分别为 K HA 、 K HB 、 K HD ,其中最大的是____。? (2)当滴定至P点时,该溶液中各种离子浓度由大到小依次是_____。? (3)若分别滴定到pH=7,此时三种溶液中的主要阴离子浓度大小关系为_____。? (4)当中和百分数达100%时,所需n(NaOH)的大小关系是_____;若将此时的三种溶液混合,其中的c(O H ? )=_____(用溶液中其他粒子的浓度表示)。? 化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25?℃时,浓度均为0.10?mol/L的C H 3 COOH和C H 3 COONa的缓冲溶液,pH=4.76。回答下列问题: [ k a (C H 3 COOH)=1.75× 10 ?5 , K b 为盐的水解常数] (1)C H 3 COOH的电离方程式_____。 (2)该缓冲溶液中离子浓度由大到小的顺序是_____。 (3)25?℃时, K a (C H 3 COOH)_____ K b (C H 3 CO O ? )(填“>”、“<”或“=”)。 (4)向1.0?L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c( H + )=_____mol/L。 (5)人体血液存在 H 2 C O 3 (C O 2 )和NaHC O 3 的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是_____(填写选项字母)。 a.代谢产生的 H + 被HC O 3 ? 结合形成 H 2 C O 3 b.血液中的缓冲体系可抵抗大量酸、碱的影响 c.代谢产生的碱被 H + 中和, H + 又由 H 2 C O 3 电离补充 NaHS溶液 水解方程式:_____; 离子浓度大小关系:_____; 电荷守恒:_____; 物料守恒:_____; 质子守恒:_____。 (l)常温下,0.1mol/LNaHC O 3 溶液的pH大于7,则溶液中c( H 2 C O 3 )_____c(C O 3 2? )?(填“>”、“=”或“<”);常温下,已知0.1mol/LNaHC O 3 溶液的pH等于8,则溶液中c( H 2 C O 3 )? ... ...
~~ 您好,已阅读到文档的结尾了 ~~

