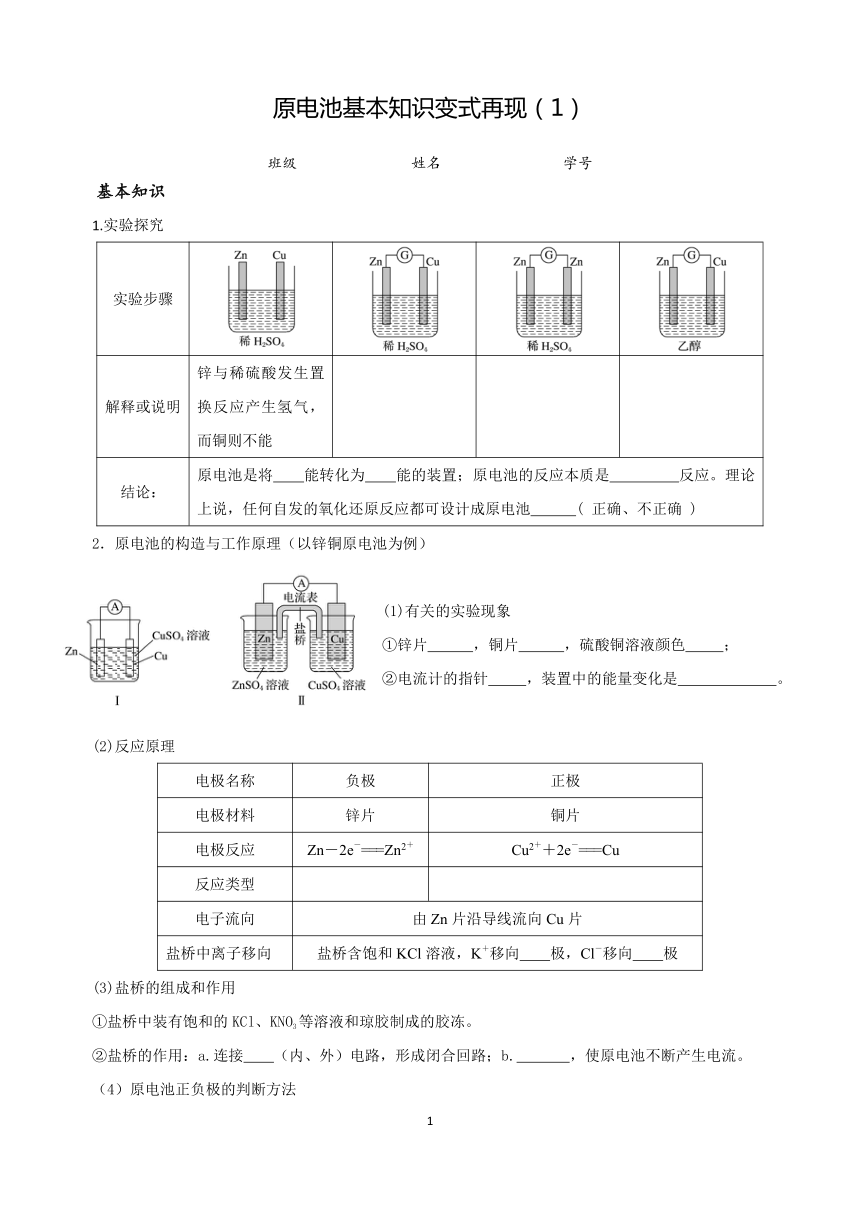
原电池基本知识变式再现(1) 班级 姓名 学号 基本知识 1.实验探究 实验步骤 解释或说明 锌与稀硫酸发生置换反应产生氢气,而铜则不能 结论: 原电池是将 能转化为 能的装置;原电池的反应本质是 反应。理论上说,任何自发的氧化还原反应都可设计成原电池 ( 正确、不正确 ) 2.原电池的构造与工作原理(以锌铜原电池为例) (1)有关的实验现象 ①锌片 ,铜片 ,硫酸铜溶液颜色 ; ②电流计的指针 ,装置中的能量变化是 。 (2)反应原理 电极名称 负极 正极 电极材料 锌片 铜片 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 电子流向 由Zn片沿导线流向Cu片 盐桥中离子移向 盐桥含饱和KCl溶液,K+移向 极,Cl-移向 极 (3)盐桥的组成和作用 ①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。 ②盐桥的作用:a.连接 (内、外)电路,形成闭合回路;b. ,使原电池不断产生电流。 (4)原电池正负极的判断方法 (1)根据组成原电池的电极材料判断。一般是活动性较强的金属为_____极,活动性较弱的金属或能导电的非金属为_____极。从更本质上说,氧化反应发生在 (正、负)极,还原反应发生在 (正、负)极。 (2)根据电流方向或电子流动方向判断。电流由___极经外电路流向___极;电子由___极经外电路流向___极。 (3)根据电解质溶液离子的移动方向判断。在原电池的电解质溶液内,阳离子移向__极,阴离子移__极。 (4)根据两极发生的变化来判断。原电池的____ 极失电子发生氧化反应,其___极得电子发生还原反应。 (5)根据现象判断。一般情况下,溶解的一极为_____极,增重或有气体逸出的一极为_____极。 变式再现 1.分析下图所示的四个原电池装置,其中结论正确的是( ) A.①②中Mg作负极,③④中Fe作负极 B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑ C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+ D.④中Cu作正极,电极反应式为2H++2e-===H2↑ 2.根据下图,下列判断中正确的是( ) A.烧杯a中的溶液pH降低 B.烧杯b中发生氧化反应 C.烧杯a中发生的反应为2H++2e-===H2↑ D.烧杯b中发生的反应为2Cl--2e-===Cl2↑ 3.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题: (1)外电路的电流方向是由_____(填字母,下同)极流向_____极。 (2)电池正极反应式为_____。 (3)是否可用水代替电池中的混合有机溶剂?_____(填“是”或“否”), 原因是_____ _____。 参考答案及解析: 基本知识 1.从左到右从上到下:锌与稀硫酸反应,但氢气在铜片上产生,导线中有电流;锌与稀硫酸反应产生氢气,但导线中无电流;乙醇是非电解质,与锌、铜都不反应;化学 电 氧化还原 正确 。 2. (1) ①溶解,加厚变亮,变浅;②发生偏转,化学能转化为电能。 (2)反应原理 氧化反应 还原反应; 正 负 (3) ②内;平衡电荷。 (4)(1)负 正 负 正 (2)正 负 负 正 (3)正 负 (4)负 正 (5)负 正 变式再现 1.答案B。解析 ②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓HNO3反应失去电子作负极,A、C错;②中电池总反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极反应式为2Al+8OH--6e-===2AlO+4H2O,二者相减得到正极反应式为6H2O+6e-===6OH-+3H2↑,B正确;④中Cu是正极,电极反应式为O2+2H2O+4e-===4OH-,D错。 2.答案B。解析 由题给原电池装置可知,电子经过导线,由Zn电极流向Fe电极,则O2在Fe电极发生还原反应:O2+2H2O+4e-===4OH-,烧杯a中c(OH-)增大,溶液的pH升高;烧杯b中,Zn发生氧化反应:Zn-2e ... ...
~~ 您好,已阅读到文档的结尾了 ~~