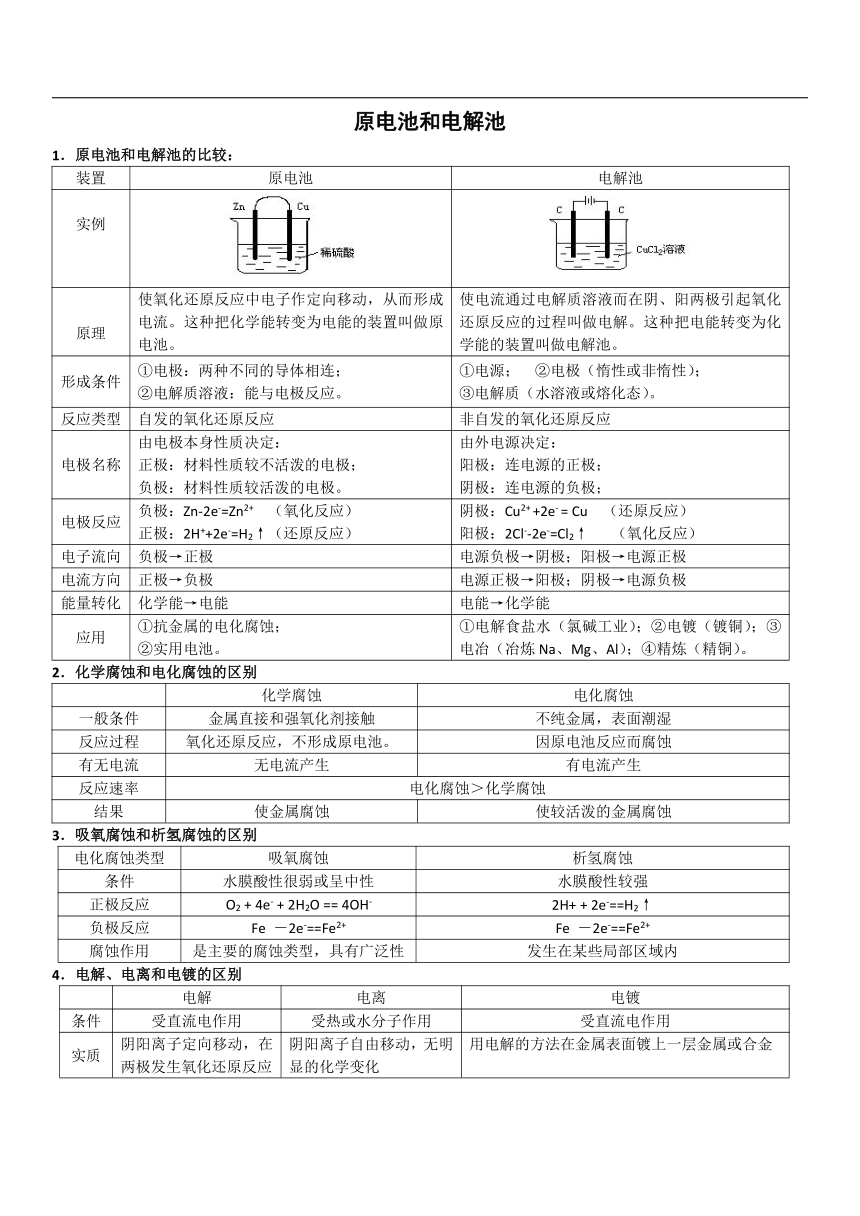
原电池和电解池 1.原电池和电解池的比较: 装置 原电池 电解池 实例 原理 使氧化还原反应中电子作定向移动,从而形成电流。这种把化学能转变为电能的装置叫做原电池。 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。这种把电能转变为化学能的装置叫做电解池。 形成条件 ①电极:两种不同的导体相连; ②电解质溶液:能与电极反应。 ①电源; ②电极(惰性或非惰性); ③电解质(水溶液或熔化态)。 反应类型 自发的氧化还原反应 非自发的氧化还原反应 电极名称 由电极本身性质决定: 正极:材料性质较不活泼的电极; 负极:材料性质较活泼的电极。 由外电源决定: 阳极:连电源的正极; 阴极:连电源的负极; 电极反应 负极:Zn-2e-=Zn2+ (氧化反应) 正极:2H++2e-=H2↑(还原反应) 阴极:Cu2+ +2e- = Cu (还原反应) 阳极:2Cl--2e-=Cl2↑ (氧化反应) 电子流向 负极→正极 电源负极→阴极;阳极→电源正极 电流方向 正极→负极 电源正极→阳极;阴极→电源负极 能量转化 化学能→电能 电能→化学能 应用 ①抗金属的电化腐蚀; ②实用电池。 ①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。 2.化学腐蚀和电化腐蚀的区别 化学腐蚀 电化腐蚀 一般条件 金属直接和强氧化剂接触 不纯金属,表面潮湿 反应过程 氧化还原反应,不形成原电池。 因原电池反应而腐蚀 有无电流 无电流产生 有电流产生 反应速率 电化腐蚀>化学腐蚀 结果 使金属腐蚀 使较活泼的金属腐蚀 3.吸氧腐蚀和析氢腐蚀的区别 电化腐蚀类型 吸氧腐蚀 析氢腐蚀 条件 水膜酸性很弱或呈中性 水膜酸性较强 正极反应 O2 + 4e- + 2H2O == 4OH- 2H+ + 2e-==H2↑ 负极反应 Fe -2e-==Fe2+ Fe -2e-==Fe2+ 腐蚀作用 是主要的腐蚀类型,具有广泛性 发生在某些局部区域内 4.电解、电离和电镀的区别 电解 电离 电镀 条件 受直流电作用 受热或水分子作用 受直流电作用 实质 阴阳离子定向移动,在两极发生氧化还原反应 阴阳离子自由移动,无明显的化学变化 用电解的方法在金属表面镀上一层金属或合金 实例 CuCl2 Cu+Cl2 CuCl2==Cu2++2Clˉ 阳极 Cu -2e- = Cu2+ 阴极 Cu2++2e- = Cu 关系 先电离后电解,电镀是电解的应用 5.电镀铜、精炼铜比较 电镀铜 精炼铜 形成条件 镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子 粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液 电极反应 阳极 Cu -2e- = Cu2+ 阴极 Cu2++2e- = Cu 阳极:Zn - 2e- = Zn2+ Cu - 2e- = Cu2+ 等 阴极:Cu2+ + 2e- = Cu 溶液变化 电镀液的浓度不变 溶液中溶质浓度减小 6.电解方程式的实例(用惰性电极电解): 电解质溶液 阳极反应式 阴极反应式 总反应方程式 (条件:电解) 溶液酸碱性变化 CuCl2 2Cl--2e-=Cl2↑ Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑ ——— HCl 2Cl--2e-=Cl2↑ 2H++2e-=H2↑ 2HCl=H2↑+Cl2↑ 酸性减弱 Na2SO4 4OH--4e-=2H2O+O2↑ 2H++2e-=H2↑ 2H2O=2H2↑+O2↑ 不变 H2SO4 4OH--4e-=2H2O+O2↑ 2H++2e-=H2↑ 2H2O=2H2↑+O2↑ 消耗水,酸性增强 NaOH 4OH--4e-=2H2O+O2↑ 2H++2e-=H2↑ 2H2O=2H2↑+O2↑ 消耗水,碱性增强 NaCl 2Cl--2e-=Cl2↑ 2H++2e-=H2↑ 2NaCl+2H2O=H2↑+Cl2↑+2NaOH H+放电,碱性增强 CuSO4 4OH--4e-=2H2O+O2↑ Cu2+ +2e-= Cu 2CuSO4+2H2O=2Cu+ O2↑+2H2SO4 OHˉ 放电,酸性增强 考点解说 1.电化腐蚀:发生原电池反应,有电流产生 (1)吸氧腐蚀 负极:Fe-2e-==Fe2+ 正极:O2+4e-+2H2O==4OH- 总式:2Fe+O2+2H2O==2Fe(OH)2 4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀: CO2+H2OH2CO3H++HCO3- 负极:Fe -2e-==Fe2+ 正极:2H+ + 2e-==H2↑ 总式:Fe + 2CO2 + 2H2O = Fe ... ...
~~ 您好,已阅读到文档的结尾了 ~~

