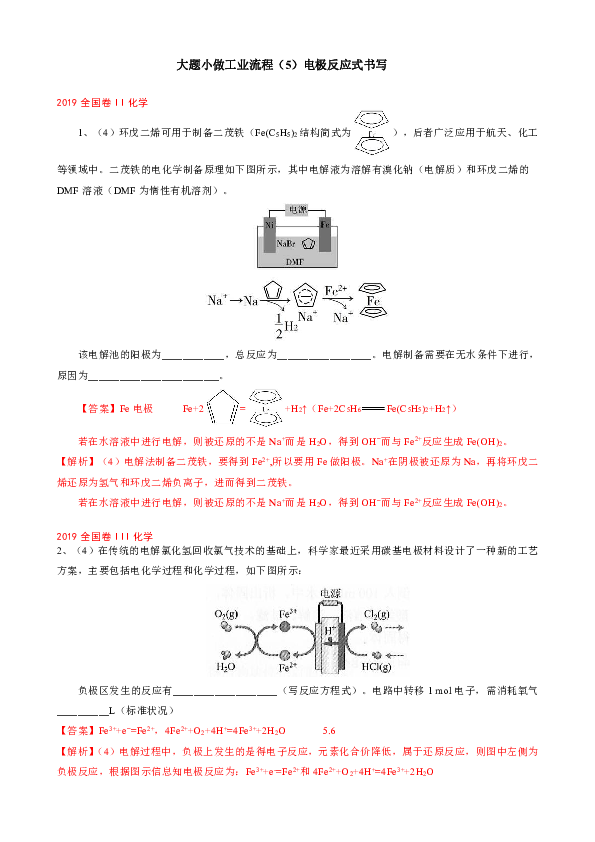
大题小做工业流程(5)电极反应式书写 2019全国卷II化学 1、(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 该电解池的阳极为_____,总反应为_____。电解制备需要在无水条件下进行,原因为_____。 【答案】Fe电极 Fe+2=+H2↑(Fe+2C5H6Fe(C5H5)2+H2↑) 若在水溶液中进行电解,则被还原的不是Na+而是H2O,得到OH?而与Fe2+反应生成Fe(OH)2。 【解析】(4)电解法制备二茂铁,要得到Fe2+,所以要用Fe做阳极。Na+在阴极被还原为Na,再将环戊二烯还原为氢气和环戊二烯负离子,进而得到二茂铁。 若在水溶液中进行电解,则被还原的不是Na+而是H2O,得到OH?而与Fe2+反应生成Fe(OH)2。 2019全国卷III化学 2、(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示: 负极区发生的反应有_____(写反应方程式)。电路中转移1 mol电子,需消耗氧气_____L(标准状况) 【答案】Fe3++e?=Fe2+,4Fe2++O2+4H+=4Fe3++2H2O 5.6 【解析】(4)电解过程中,负极上发生的是得电子反应,元素化合价降低,属于还原反应,则图中左侧为负极反应,根据图示信息知电极反应为:Fe3++e-=Fe2+和4Fe2++O2+4H+=4Fe3++2H2O 电路中每转移1 mol电子,就有1 molH+转移至负极区,结合负极反应式,可求得消耗的氧气为0.25mol,在标况下体积即为5.6L。 2018新课标Ⅰ 3、(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3.阳极的电极反应式为 。电解后, 室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5 【答案】 2H2O﹣4e﹣═O2↑+4H+;a; 【解析】 电解池阳极为稀硫酸溶液,电解质溶液显酸性,电解池阳极发生氧化反应,所以应为H2O放电,产生O2和H+,则电极反应为:2H2O﹣4e﹣═O2↑+4H+, 溶液中分隔各个室的膜为阳离子交换膜,阳离子向阴极移动,H+向右移动,在b室则发生反应:2H++2e﹣═H2↑,所以b室较a室H+浓度有所降低,因此电解后,a室的NaHSO3浓度增加, 2018新课标Ⅲ 4、(3)KIO3也可采用“电解法”制备,装置如图所示。 ①写出电解时阴极的电极反应式 。 ②电解过程中通过阳离子交换膜的离子主要为 ,其迁移方向是 。 【答案】2H2O+2e﹣═2OH﹣+H2↑ 。 K+ a到b 【解析】 ①电解池阴极为KOH溶液,电解质溶液呈碱性,电解池阴极发生还原反应,过程应为H2O转化为H2,据此写出阴极电极反应; ②隔膜是阳离子交换膜,起主要交换的离子应为K+,电解池工作时,阳离子向阴极移动; ③电解法过程中,阳极发生反应I2﹣10e﹣+12OH﹣═2IO3﹣+6H2O制备KIO3,整个电解池装置没有产生氧化法过程中的Cl2,即没有产生污染大气环境的有毒气体。 2019江苏节选 5、CO2的资源化利用能有效减少CO2排放,充分利用碳资源。 (2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。 ①写出阴极CO2还原为HCOO?的电极反应式: ▲ 。 ②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是 ▲ 。 【答案】(2)①CO2+H++2e?HCOO?或CO2++2e?HCOO?+ ②阳极产生O2,pH减小,浓度降低;K+部分迁移至阴极区 【解析】(2)①根据电解原理,阴极上得到电子,化合价降低,CO2+HCO3?+2e? =HCOO?+CO32?,或CO2+H++2e? =HCOO?;②阳极反应式为2H2O?4e? =O2↑+4H+,阳极附近pH减小,H+与HCO3? 反应,同时部分K+迁移至阴极区,所以电解一段时间后,阳极区的KHCO3溶液浓度降低。 (2019·高考名校联考信息优化卷) 6、(6)在碱性条 ... ...
~~ 您好,已阅读到文档的结尾了 ~~