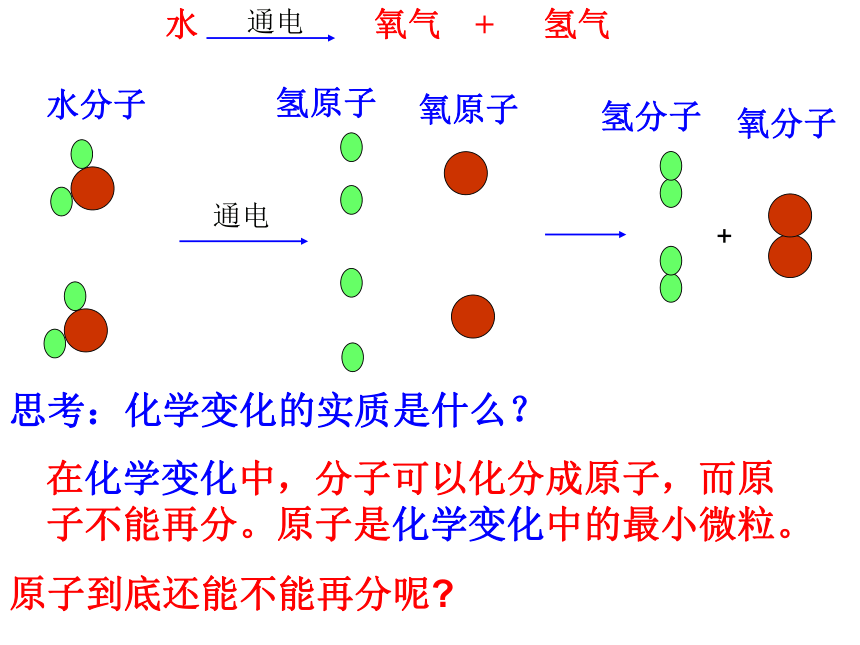
水 氧气 + 氢气 电解 通电 + 水分子 氢原子 氧原子 氢分子 氧分子 思考:化学变化的实质是什么? 通电 原子到底还能不能再分呢? 在化学变化中,分子可以化分成原子,而原子不能再分。原子是化学变化中的最小微粒。 第二单元 探秘水世界 第三节 原子的构成 第一课时 19世纪初,英国化学家道尔顿创立了原子论,他认为原子是一个不可再分割的实心球体。 “原子”一词源自古希腊,希腊语中是不可再分的意思。 高压真空放电管 带负电荷的粒子流 1897年,汤姆森的实验 不论阴极材料是什么,都会发射出电子。 电子带负电荷,怎么保证原子为电中性呢? 汤姆森———发现了电子,认为 原子是可分的! 汤姆森的原子模型———西瓜模型(“葡萄干布丁”模型) 该模型不久就被一个实验事实否定了 1911年,卢瑟福的α粒子散射实验 带正电荷、质量远大于电子 说明:有相对很大的空间 说明:有一个带正电的微粒 说明: 有一个体积很小、 质量很大、带正电荷的微粒。 2、极少数α粒子被弹回来 3、少数α粒子发生偏转 1、大多数α粒子未发生偏转 卢瑟福行星式原子结构模型 行星绕太阳旋转 原子是由居于原子中心的带正电荷的原子核和核外带负电的电子构成,原子的全部正电荷与几乎全部的质量都集中在原子核上;带负电的电子在核外空间绕核高速旋转。就像行星环绕太阳运转一样。 卢瑟福获1908年 诺贝尔化学奖 若将原子比做一个庞大的体育场,而原子核只相当于一只蚂蚁。 质子: 中子: 一、原子的构成 原子核 (+) 核外电子: (-) 原子 不显 电性 每个电子带1个单位负电荷 每个质子带1个单位正电荷 不带电 粒子种类 电性 质量 质子 一个单位正电荷 1.672×10-27 kg 中子 不带电 1.674 ×10-27kg 电子 一个单位负电荷 质子质量的1/1836 构成原子的粒子的电性和质量 质子: 一、原子的构成 中子: 原子核 (+) 核外电子: (-) 原子 不显 电性 每个电子带1个单位负电荷 每个质子带1个单位正电荷 不带电 2、原子的质量几乎全部集中在原子核上。 在原子中: 1、核电荷数=质子数= 核外电子数=原子序数 3、原子不显电性的原因:原子核所带的正电荷与核外电子所带的负电荷电量相等 电性相反 相互抵消 下表是几种原子的基本构成,请完成表中信息,你能得出哪些结论? 原子种类 符号 核电荷数 质子数 中子数 电子数 氢 H 1 0 1 氧 O 8 8 8 钠 Na 11 12 氯 Cl 17 18 碳-12 C-12 6 6 碳-13 C-13 7 6 碳-14 C-14 6 8 下表是几种原子的基本构成,请完成表中信息,你能得出哪些结论? 原子种类 符号 核电荷数 质子数 中子数 电子数 氢 H 1 1 0 1 氧 O 8 8 8 8 钠 Na 11 11 12 11 氯 Cl 17 17 18 17 碳-12 C-12 6 6 6 6 碳-13 C-13 6 6 7 6 碳-14 C-14 6 6 8 6 1、核电荷数=质子数=核外电子数 从表中可以得出: 2、不是所有的原子都含有中子 4、核内质子数不一定等于中子数 3、不同种类的原子核内质子数不同 原子也是构成物质的一种基本粒子 金属(如:金 Au,铁Fe,铜Cu, 铝Al,镁Mg等等) 某些固态非金属(如:金刚石C, 石墨C等等) 稀有气体(如:氦气He,氖气Ne, 氩气Ar等等) 由原子构成的物质 原子也具有微观粒子的一般特征(性质) 1、小———质量和体积很小 2、动———原子总在不断运动 3、力———原子间存在相互作用 4、间�———原子间有间隔 2、原子由 和 构成, 原子核又由 构成 3、原子中一定含有的微粒是——— 课堂练习 1.填写下表 原子种类 核电荷数 质子数 电子数 氢 1 碳 6 氧 8 硫 16 质子和 电子(或原子核和电子) 原子核 电子 质子和 中子 1 1 8 16 16 8 6 6 4、原子不显电性的原因是 . 5、某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为 . 6、我国已发射一颗绕月球探测卫星,其任务之一是寻找 ... ...
~~ 您好,已阅读到文档的结尾了 ~~