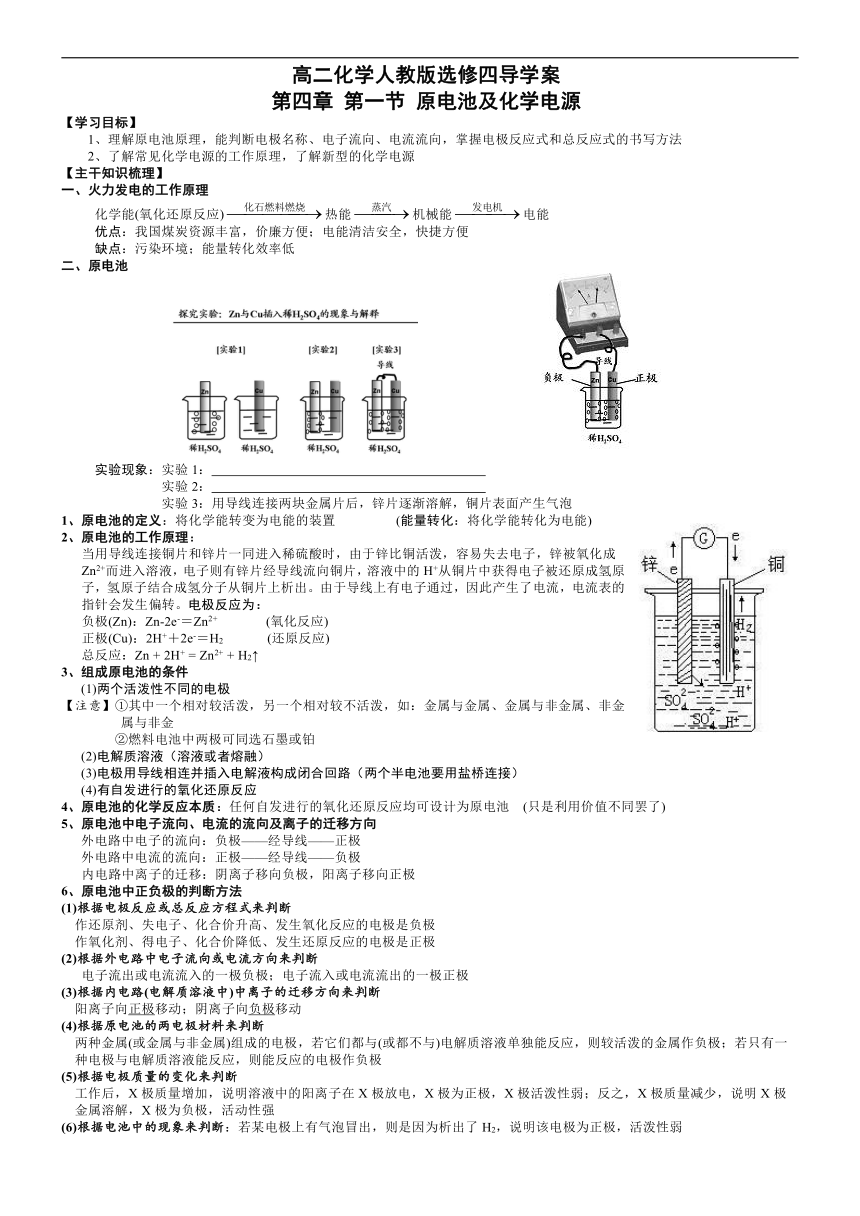
高二化学人教版选修四导学案 第四章 第一节 原电池及化学电源 【学习目标】 1、理解原电池原理,能判断电极名称、电子流向、电流流向,掌握电极反应式和总反应式的书写方法 2、了解常见化学电源的工作原理,了解新型的化学电源 【主干知识梳理】 一、火力发电的工作原理 化学能(氧化还原反应)热能机械能电能 优点:我国煤炭资源丰富,价廉方便;电能清洁安全,快捷方便 缺点:污染环境;能量转化效率低 二、原电池 实验现象:实验1: 实验2: 实验3:用导线连接两块金属片后,锌片逐渐溶解,铜片表面产生气泡 1、原电池的定义:将化学能转变为电能的装置 (能量转化:将化学能转化为电能) 2、原电池的工作原理: 当用导线连接铜片和锌片一同进入稀硫酸时,由于锌比铜活泼,容易失去电子,锌被氧化成 Zn2+而进入溶液,电子则有锌片经导线流向铜片,溶液中的H+从铜片中获得电子被还原成氢原 子,氢原子结合成氢分子从铜片上析出。由于导线上有电子通过,因此产生了电流,电流表的 指针会发生偏转。电极反应为: 负极(Zn):Zn-2e-=Zn2+?? (氧化反应) 正极(Cu):2H++2e-=H2 (还原反应) 总反应:Zn + 2H+ = Zn2+ + H2↑ 3、组成原电池的条件 (1)两个活泼性不同的电极 【注意】①其中一个相对较活泼,另一个相对较不活泼,如:金属与金属、金属与非金属、非金属与非金 ②燃料电池中两极可同选石墨或铂 (2)电解质溶液(溶液或者熔融) (3)电极用导线相连并插入电解液构成闭合回路(两个半电池要用盐桥连接) (4)有自发进行的氧化还原反应 4、原电池的化学反应本质:任何自发进行的氧化还原反应均可设计为原电池 (只是利用价值不同罢了) 5、原电池中电子流向、电流的流向及离子的迁移方向 外电路中电子的流向:负极———经导线———正极 外电路中电流的流向:正极———经导线———负极 内电路中离子的迁移:阴离子移向负极,阳离子移向正极 沿导线 6、原电池中正负极的判断方法 (1)根据电极反应或总反应方程式来判断 作还原剂、失电子、化合价升高、发生氧化反应的电极是负极 作氧化剂、得电子、化合价降低、发生还原反应的电极是正极 (2)根据外电路中电子流向或电流方向来判断 电子流出或电流流入的一极负极;电子流入或电流流出的一极正极 (3)根据内电路(电解质溶液中)中离子的迁移方向来判断 阳离子向正极移动;阴离子向负极移动 (4)根据原电池的两电极材料来判断 两种金属(或金属与非金属)组成的电极,若它们都与(或都不与)电解质溶液单独能反应,则较活泼的金属作负极;若只有一 种电极与电解质溶液能反应,则能反应的电极作负极 (5)根据电极质量的变化来判断 工作后,X极质量增加,说明溶液中的阳离子在X极放电,X极为正极,X极活泼性弱;反之,X极质量减少,说明X极 金属溶解,X极为负极,活动性强 (6)根据电池中的现象来判断:若某电极上有气泡冒出,则是因为析出了H2,说明该电极为正极,活泼性弱 【练习】下列哪些装置能组成原电池,若能,标明原电池的正负极 三、原电池原理的主要应用 1、加快氧化还原反应的速率:一个自发进行的氧化还原反应,设计成原电池时反应速率加快。如:在Zn与稀H2SO4反应时, 加入少量CuSO4溶液能使产生H2的反应速率加快,因为锌、铜(是锌与CuSO4反应产生的)与稀硫酸构成了原电池 【练习2】下列关于实验现象的描述不正确的是( ) A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌 C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 【练习3】实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是( ) A.纯锌与稀硫酸反应 B ... ...
~~ 您好,已阅读到文档的结尾了 ~~

